
����Ŀ��Ϊ�����е�FeCl3��FeCl2��CuCl2�ķ�Һ�е�Cu2+��ԭ���գ�ijͬѧ�ں���ag���۵������м����Һ��̽���˼����Һ�������ȫ��Ӧ����ϵ�й��������Ĺ�ϵ������ʵ���������±���ʾ����֪����Һ��c(Cu2+)=0.7 mol��L��1����Һ�������0.5L����ַ�Ӧ����ܼ���Cu2+��

����˵������ȷ����
A. ��������0.25L��Һ��Ӧ��ȫ����ɷ�ΪFe��Cu
B. ��������1L��Һ��Ӧ��ȫ���ټ����Һʱ���������ӷ�ӦΪFe +2Fe3+=3Fe2+
C. ��Һ��c(Fe3+)=0.2 mol��L��1
D. Ҫ��1L��Һ�е�Cu2+ȫ����ԭ����������Ҫ����44.8g
���𰸡�B
��������
��������ݿ�֪������Һ�����0.5Lʱ�������������䣬˵����Һ�з�����Ӧ2Fe3++Fe=3Fe2+��Fe+Cu2+=Cu+Fe2+����Fe3+����Fe����������Cu2+��Fe��Ӧ�������ӵ�����������Һ���ΪVL������56g/mol��Vc(Fe3+)/2=0.7V��8�����c(Fe3+)=0.2 mol/L������Һ������ڵ���4Lʱ����������Ϊ0��˵��ag����ֻ��Fe3+��Ӧ����ag�������ʵ���Ϊ��0.2mol/L��4L����1/2=0.4mol��a=��0.2mol/L��4L����1/2��56g/mol=22.4g��
A���������ݿ�֪������Һ���Ϊ0.25L��Һʱ�������������䣬˵����Һ�з�����Ӧ2Fe3++Fe=3Fe2+��Fe+Cu2+=Cu+Fe2+�������ù���ΪFe��Cu����A��ȷ��
B�1L��Һ��n(Fe3+)Ϊ0.2mol��n(Cu2+)Ϊ0.7mol��Fe3+��ȫ��Ӧ����0.1molFe������0.3 molFe��Cu2+��ȫ��Ӧ���õ�����ΪCu���ټ����Һʱ��Cu���Һ��Fe3+��Ӧ����Ӧ�����ӷ���ʽΪ2 Fe3++Cu=2 Fe2++ Cu2+����B����
C���Һ��c(Fe3+)=0.2 mol/L����C��ȷ��
D�1L��Һ��n(Fe3+)Ϊ0.2mol��n(Cu2+)Ϊ0.7mol��Fe3+��ȫ��Ӧ����0.1molFe��Cu2+��ȫ��Ӧ����0.7molFe��������0.8molFe������Ϊ44.8g����D��ȷ��
��ѡB��


 ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����
Ԫ�ر�� | Ԫ�ص����ʻ�ԭ�ӽṹ |
X | �����������Ǵ�����������3�� |
Y | �����µ�����˫ԭ�ӷ��ӣ����⻯���ˮ��Һ�Լ��� |
Z | ��������Ԫ�صļ������а뾶��С |
(1)Ԫ��X��һ�ֵ����������г�������ˮ�������������õ��ʵĻ�ѧʽ��________��Ԫ��Z�����ӽṹʾ��ͼΪ________��
(2)Ԫ��Y����Ԫ���γ�һ������YH![]() ����д�������ӵ���ʽ __________________��
����д�������ӵ���ʽ __________________��
(3)д��ZԪ������������Ӧ��ˮ������NaOH��Һ��Ӧ�����ӷ���ʽ��
___________________________________��
(4)Ԫ��X��Ԫ��Y��ȣ��ǽ����Խ�ǿ����________(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����________��
a��Y���⻯����ڴ�X2��ȼ������X���⻯���Y2
b��X�ĵ��ʱ�Y�ĵ��ʸ�������H2����
c��X��Y�γɵĻ�������YԪ�س�����̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǹ�ũҵ�����в��ɻ�ȱ�����ʣ��о���ȡ�����Ļ�������Ƿ���
��1���ڳ��¡���ѹ�����������£�N2�ڲ�������Fe2O3��TiO2����������ˮ�������з�Ӧ:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) ��H= a kJ mol-1��
2NH3(g)+3/2O2(g) ��H= a kJ mol-1��
Ϊ��һ���о�����NH3�����ʵ������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������£�
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
�˷�Ӧ��a_________0����S________0��������>����<������ = ����
��2�������¶Ⱥ�ѹǿ�£���2 L�ĺ����ܱ������кϳɰ���:N2(g)+3H2(g)![]() 2NH3(g) ��H="-92.4" kJ mol-1���ڷ�Ӧ�����з�Ӧ�������������ʵ�����ʱ��ı仯��ͼ��ʾ��
2NH3(g) ��H="-92.4" kJ mol-1���ڷ�Ӧ�����з�Ӧ�������������ʵ�����ʱ��ı仯��ͼ��ʾ��

��0��10 min�ڣ���NH3��ʾ��ƽ����Ӧ����Ϊ_________��
����10��20 min�ڣ�NH3Ũ�ȱ仯��ԭ�������_______��
A��������� B����С������� C�������¶� D������NH3�����ʵ���
�� 20 min�ﵽ��һ��ƽ�⣬�ڷ�Ӧ������25 minʱ�����߷����仯��ԭ����____________��35min�ﵽ�ڶ���ƽ�⣬��ƽ���ƽ�ⳣ��K1______K2������>����<������ = ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦN2(g)+O2(g)=2NO(g)�������仯��ͼ��ʾ����֪���Ͽ�1mol N2(g)�л�ѧ��������946kJ�������Ͽ�1mol O2(g)�л�ѧ��������498kJ������

����˵����ȷ����
A. N2(g)+O2(g)=2NO(g) ��H��-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) ��H��+90![]()
C. �Ͽ�1mol NO(g)�л�ѧ����Ҫ����632kJ����
D. �γ�1 mol NO(g)�л�ѧ�����ͷ�90kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��Я�ַ�����ȫ����ϩ�Ŵ�һB40��B40�ŴصĽṹ�������й��ĺ��������ͼ)�ò��Ͽ�������װ�����������ڴ��ⴢﮡ��뵼�塢��������ɫ�������������ҪӦ��ǰ��,�����й�˵����ȷ����
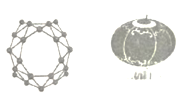
A.��ʯīϩ�Ľṹ��ͬ������Ϊͬ��������
B.44.0g�����ʺ���2.408��1024��ԭ��
C.B40�мȺ����Լ����ֺ��зǼ��Լ�
D.ȫ����ϩ�Ŵ���һ�����͵ĸ߷��Ӳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��BE���ִ��л�������Ҫ�ĵ���֮һ����ҵ�ϲ�ȡ�ұ��������Ʊ���ϩ��Ӧ�Ʊ���
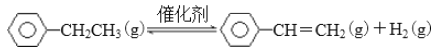
��1����֪��
��ѧ�� | C-H | C-C | C=C | H-H |
����/ | 412 | 348 | 612 | 436 |
����������Ӧ��![]() _______
_______![]() ���÷�Ӧ�ܹ�������ԭ����______
���÷�Ӧ�ܹ�������ԭ����______
��2��ά����ϵ��ѹǿp�㶨�����¶�Tʱ�����ʵ���Ϊn�����ΪV���ұ��������������ⷴӦ����֪�ұ���ƽ��ת����Ϊ![]() �����ڸ��¶��·�Ӧ��ƽ�ⳣ��K=_______����a�ȷ��ű�ʾ����
�����ڸ��¶��·�Ӧ��ƽ�ⳣ��K=_______����a�ȷ��ű�ʾ����
��3����ҵ�ϣ�ͨ�����ұ������в���ˮ���������Ʒ�Ӧ�¶�600�棬��������ϵ��ѹΪ��ѹ�������½��з�Ӧ���ڲ�ͬ��Ӧ�¶��£��ұ���ƽ��ת���ʺ�ij���������±���ϩ��ѡ���ԣ�ָ����![]() ����IJ����б���ϩ�����ʵ���������ʾ��ͼ��ͼ��ʾ��
����IJ����б���ϩ�����ʵ���������ʾ��ͼ��ͼ��ʾ��

a������ˮ����������ұ���ƽ��ת���ʣ�����˵������ʵ__________��
b�����Ʒ�Ӧ�¶�Ϊ![]() ��������___________
��������___________
��4��������̱���ϩ�������ұ��IJ����У���������л���![]() ��
��![]() �����ʣ�����������ж�����˱����ȥ���ڳ����£�������������Һ���������
�����ʣ�����������ж�����˱����ȥ���ڳ����£�������������Һ���������![]() ����ԭ����������Ӧ���ƣ�����������д��������Һ��
����ԭ����������Ӧ���ƣ�����������д��������Һ��![]() ��Ӧ�����ӷ���ʽ________________��
��Ӧ�����ӷ���ʽ________________��
��5������ϩ�����ڹ�ҵ�ϳ��õ������������ԭ����ͼ��ʾ��

д�������缫��ӦʽIΪ______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ������ ��
A��MnO2��Ũ���ᷴӦ��Cl2��MnO2��4HCl![]() Mn2����2Cl����Cl2����2H2O
Mn2����2Cl����Cl2����2H2O
B��̼����������Һ��Ӧ��CaCO3 + 2H+ = Ca2+ + H2O + CO2��
C��200mL2mol/L��FeBr2��Һ��ͨ��11.2L��״���µ�������
4Fe2�� + 6Br��+ 5Cl2 == 4Fe3�� + 3Br2 + 10Cl��
D��Na2S��ˮ����S2- + 2H2O ![]() H2S + 2OH-
H2S + 2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ��۲���ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��NaHS��Һ�е����̪ | ��Һ���ɫ | HS-ˮ��̶ȴ��ڵ���̶� |
B | ��Ũ�Ⱦ�Ϊ0.1mol/L��MgCl2��CuCl2�����Һ����μ��백ˮ | ������ɫ���� | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | ��Na2CO3��Һ�м���Ũ���ᣬ������������ͨ���������Һ�� | ������ɫ���� | ���ԣ����̼����� |
D | ��ʢ��KI3��Һ�����Թ��зֱ���������Һ��AgNO3��Һ | ǰ����Һ����ɫ�������л�ɫ���� | KI3��Һ�д���I |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�������Լ���ǩ�ϵIJ������ݣ��ݴ�����˵����ȷ���ǣ� ��

A.�������Լ������ʵ���Ũ��Ϊ18.4mol��L-1
B.��������Ը���H2S���������壬�������Ը���NH3
C.50mL��H2SO4�м���������ͭƬ�����ȣ�����ԭ��H2SO4�����ʵ���Ϊ0.46mol
D.2.7gAl�������ĸ����ᷴӦ�ɵõ�H23.36L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com