
| A. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| B. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 医用酒精是利用了乙醇的氧化性来杀菌消毒的 |
分析 A.新型无机非金属材料主要有先进陶瓷、非晶体材料、人工晶体、无机涂层、无机纤维等;
B.玛瑙和砂子主要成分都是二氧化硅;
C.明矾具有净水作用,不具有杀菌消毒作用;
D.乙醇不具有强氧化性.
解答 解:A.航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,碳纤维复合材料是主要由碳单质做成,是一种复合材料,故A正确;
B.玛瑙饰品的主要成分与建筑材料砂子相同,都是二氧化硅,故B正确;
C.明矾净水时,铝离子发生水解反应,生成氢氧化铝具有净水作用,发生了化学及物理变化,氢氧化铝不具有氧化性,不能杀菌消毒,故C正确;
D.乙醇能够使蛋白质变性,所以用来杀菌消毒,但是乙醇不具有强氧化性,故D错误;
故选:D.
点评 本题考查了生活中的化学,熟悉硅及其化合物性质及用途,明矾净水原理,蛋白质性的变性是解题关键,题目难度不大,注意积累.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:实验题
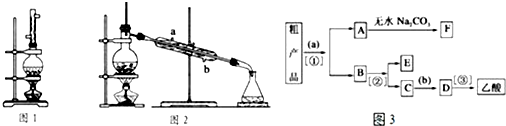
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
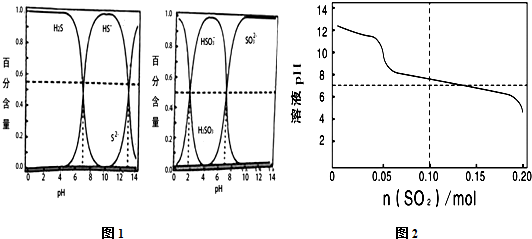
| A. | 由图1的一级电离与二级电离的Ka值可知H2SO3?2H++SO32- Ka≈10-7 | |
| B. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存 | |
| C. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中存在如下关系:c(H+)+c(Na+)═c(OH-)+2c(S2-)+2c(SO32-)+c(HS- )+c(HSO3-) | |
| D. | 在反应过程中当pH降至7.5左右,之后可能出现淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
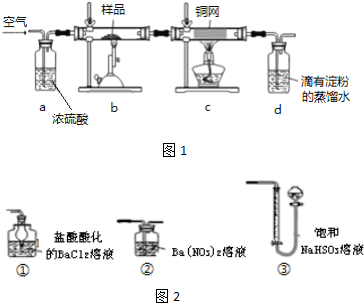
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、S2-、Cl- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com