

分析 (1)图2装置中Fe丝可以抽动,能控制反应的发生和停止,有尾气处理装置;
(2)导气管e与外界连通能起到平衡压强防止倒吸的作用;
(3)二氧化硫能够使品红溶液褪色;二氧化硫为酸性氧化物,与氢氧化钠溶液反应生成亚硫酸钠和水;
(4)验证Ⅱ:检验Fe2+,先加KSCN溶液,再加H2O2溶液;
验证Ⅲ:步骤1.检验Fe3+,加KSCN溶液,变红色;或加淀粉KI溶液,变蓝色;
步骤2.既有Fe3+又有Fe2+时,检验Fe2+要加酸性KMnO4溶液.
解答 解:(1)图2装置中Fe丝可以抽动,能控制反应的发生和停止,而且有尾气处理装置,
故答案为:便于控制反应的发生和停止;
(2)导气管e与外界连通,停止加热时能起到平衡压强防止倒吸的作用,
故答案为:停止加热时,能防止倒吸或平衡压强;
(3)二氧化硫具有漂白性,能是品红溶液褪色,所以若品红溶液褪色,证明有二氧化硫气体产生;二氧化硫与氢氧化钠溶液反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:品红溶液褪色;SO2+2OH-=SO32-+H2O;
(4)Ⅱ为只含有Fe2+,验证Ⅱ时,需要先加KSCN溶液,溶液不变红,然后再加H2O2溶液,若此时溶液变成红色,则证明只含有亚铁离子,
故答案为:C,G;
Ⅲ为既有Fe3+又有Fe2+;验证Ⅲ的方法为:步骤1:检验Fe3+,加KSCN溶液,变红色,发生的反应为:Fe3++3SCN-═Fe(SCN)3;或加淀粉KI溶液,变蓝色,其反应为:2I-+2Fe3+=I2+2Fe2+;
故答案为:C(或F);红(或蓝),Fe3++3SCN-═Fe(SCN)3或2I-+2Fe3+=I2+2Fe2+;
步骤2.再验证亚铁离子,需要使用酸性高锰酸钾溶液,方法为:加酸性KMnO4溶液,高锰酸钾溶液褪色证明有二价铁离子,反应的离子方程式为:5Fe2++MO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:D;紫红色褪去或变浅;5Fe2++MO4-+8H+=5Fe3++Mn2++4H2O.
点评 本题通过浓硫酸的性质,侧重考查性质实验方案的设计与评价,题目难度中等,明确铁离子、亚铁离子的检验方法为解答关键,注意掌握性质实验方案的设计原则,试题充分考查了学生的分析能力及化学实验能力.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 将湿润淀粉碘化钾试纸检验某溶液 | 试纸变蓝 | 该溶液一定是氯水 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 | B. | 乙酸和硬脂酸 | ||
| C. | 苯甲酸和  | D. | 硝基乙烷(CH3CH2NO2)和氨基乙酸5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
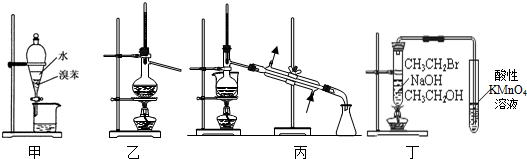
| A. | 甲装置:用所示装置分离出溴苯 | |
| B. | 乙装置:加热浓硫酸和乙醇混合液,制取乙烯 | |
| C. | 丙装置:加热苯和硝基苯的混合物,分离出苯 | |
| D. | 丁装置:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
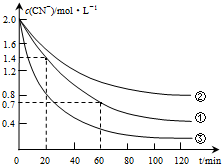 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
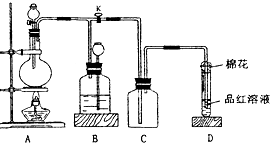 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com