
(1)画出NH3和NF3分子的空间构型,并用σ+和σ-表示出键的极性。
(2)比较这两个分子极性大小并说明原因。
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
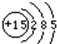
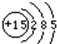
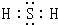
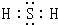


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| C2(NH3) |
| C (N2)C3(H2) |
| C2(NH3) |
| C (N2)C3(H2) |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省哈六中高一下学期期中考试化学试题 题型:填空题
(20分)回答下列问题
(1)画出磷原子的原子结构示意图: 。
(2)写出H2S分子的电子式: 。
(3)写出表示含有8个质子,10个中子的原子的化学符号: 。
。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a = 。
(5)用电子式表示氯化镁的形成过程:  。
。
(6)写出Na2O2中所含化学键的类型 。
(7)拆开1mol H—H键,1mol N—H键,1mol 键分别需要吸收的能量为436kJ ,391kJ,946kJ:
键分别需要吸收的能量为436kJ ,391kJ,946kJ:
则1mol N2完全转化成NH3 热量(填“吸收”或“放出”) kJ;
(8)利用下列反应:Fe + Cu2+ = Fe 2+ + Cu 制一个化学电池,写出电极反应式:
负极: ;正极 。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省高一下学期期中考试化学试题 题型:填空题
(20分)回答下列问题
(1)画出磷原子的原子结构示意图: 。
(2)写出H2S分子的电子式: 。
(3)写出表示含有8个质子,10个中子的原子的化学符号: 。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a = 。
(5)用电子式表示氯化镁的形成过程: 。
(6)写出Na2O2中所含化学键的类型 。
(7)拆开1mol H—H键,1mol N—H键,1mol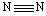 键分别需要吸收的能量为436kJ ,391kJ,946kJ:
键分别需要吸收的能量为436kJ ,391kJ,946kJ:
则1mol N2完全转化成NH3 热量(填“吸收”或“放出”) kJ;
(8)利用下列反应:Fe + Cu2+ = Fe 2+ + Cu 制一个化学电池,写出电极反应式:
负极: ;正极 。
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省高一下学期期中考试化学试卷 题型:填空题
(20分)回答下列问题
(1)画出磷原子的原子结构示意图: 。
(2)写出H2S分子的电子式: 。
(3)写出表示含有8个质子,10个中子的原子的化学符号: 。
(4)已知阴离子aXm-和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a = 。
(5)用电子式表示氯化镁的形成过程: 。
(6)写出Na2O2中所含化学键的类型 。
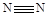 (7)拆开1mol H—H键,1mol N—H键,1mol 键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3可 热量(填“吸收”或“放出”)
kJ;
(7)拆开1mol H—H键,1mol N—H键,1mol 键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3可 热量(填“吸收”或“放出”)
kJ;
(8)利用下列反应:Fe+Cu2+ =Fe 2+ + Cu 设计一个原电池,写出电极反应式:
负极: ;正极 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com