工业上对海水资源综合开发利用的部分工艺流程如图1所示.
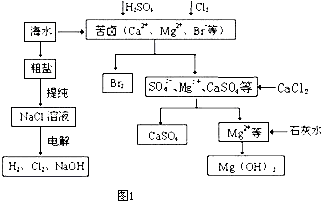
(1)粗盐中含有Ca
2+、Mg
2+、SO
42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl
2溶液、过量的NaOH溶液和过量的Na
2CO
3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入Na
2CO
3溶液后相关化学反应的离子方程式:
Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
.
(2)本工艺流程中先后制得Br
2、CaSO
4、Mg(OH)
2,能否按Br
2、Mg(OH)
2、CaSO
4的顺序制备?
否
否
(填“能”或“否”),原因是
如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯
.
(3)氯化钠是重要的氯碱工业化工的原料.电解饱和食盐水常用离子膜电解槽和隔膜电解槽.离子膜和隔膜均允许通过的分子或离子是
B
B
.
A.Cl
- B.Na
+ C.OH
- D.Cl
2(4)饱和食盐水电解时与电源正极相连的电极上发生的反应为
氧化反应,2Cl--2e-=Cl2↑
氧化反应,2Cl--2e-=Cl2↑
,与电源负极线连的电极附近溶液pH
变大
变大
(变大、不变、变小).
(5)氯化钠的可用于生产纯碱,我国化学家侯德榜改革国外生产工艺,生产流程简要表示如图2:
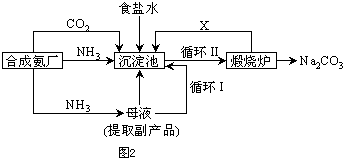
①上述生产纯碱的方法称
联合制碱法
联合制碱法
,副产品的一种用途为
做化肥
做化肥
.
写出上述流程中X物质的分子式
CO2
CO2
.使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
Ⅰ
Ⅰ
(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是
过滤
过滤
.
②合成氨原料气中氮气制备的方法之一为
液态空气依据沸点分离
液态空气依据沸点分离
,另一原料气氢气的制取化学方程式为
.
③沉淀池中发生的化学反应方程式是
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
.要实现该反应,你认为应该如何操作:
向氨化的饱和氯化钠溶液中通入二氧化碳气体得到碳酸氢钠晶体
向氨化的饱和氯化钠溶液中通入二氧化碳气体得到碳酸氢钠晶体
;
④为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
用硝酸酸化的硝酸银,观察产生白色沉淀
用硝酸酸化的硝酸银,观察产生白色沉淀
.



