
| 1.8g |
| 90g/mol |
| 1.08g |
| 18g/mol |
| 2.64g |
| 44g/mol |
| 90-12×3-1×6 |
| 16 |
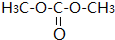 ,
,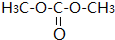 .
.


科目:高中化学 来源: 题型:
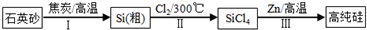
查看答案和解析>>
科目:高中化学 来源: 题型:
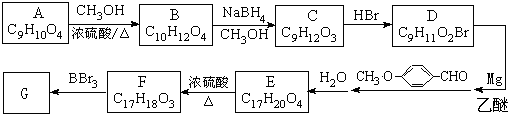
 ).
).
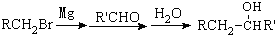
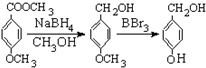
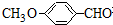 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
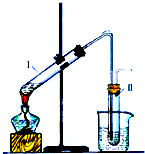 如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:
如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中一定含有Fe2+ |
| B、溶液中一定含Cu2+ |
| C、剩余固体中一定含铜 |
| D、加入KSCN溶液一定不变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
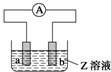 如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,
如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,| a极板 | b极板 | a电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 正极 | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
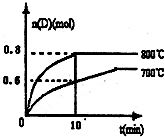 (1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1
(1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com