
【题目】t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
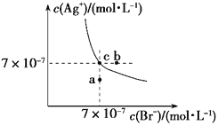
A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
【答案】B
【解析】
根据图示可知:在线上的点为饱和溶液,在线左下方的点溶液未达到饱和,在线右上方的点是过饱和溶液,据此解答。
A.根据图像可知在t℃时,Ksp(AgBr)=c(Br-)·c(Ag+)=7×10-7×7×10-7=4.9×10-13,A正确;
B、蒸发时溶液体积减少,离子浓度均增大,所以通过蒸发,不可能使溶液由a点变到c点,B错误;
C、图中b点在线的右上方,由于c(Br-)·c(Ag+)>Ksp(AgBr)=4.9×10-13,所以图中b点有AgBr沉淀析出,C正确;
D、t℃时,AgCl的Ksp=c(Cl-)·c(Ag+)=4×10-10,Ksp(AgBr)=c(Br-)·c(Ag+)=4.9×10-13,则AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K=c(Cl-)÷c(Br-)=Ksp(AgCl)÷Ksp(AgBr)=4×10-10÷4.9×10-13≈816,D正确。
AgBr(s)+Cl-(aq)的平衡常数K=c(Cl-)÷c(Br-)=Ksp(AgCl)÷Ksp(AgBr)=4×10-10÷4.9×10-13≈816,D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 稀硫酸用于除铁锈 B. 碳酸钠用于治疗胃酸过多
C. 晶体硅用于制造光导纤维 D. 硫酸钡用于制作石膏绷带
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化中,不属于化学变化的是( )
A. SO2使品红溶液褪色 B. 氯水使紫色石蕊试液褪色
C. SO2使高锰酸钾溶液褪色 D. 活性炭使墨水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是

A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13C-NMR(NMR表示核磁共振)可用于测定蛋白质、核酸等生物大分子的空间结构。下面有关13C的叙述中,正确的是( )
A.13C与C60都为C的核素B.13C与15N有相同的中子数
C.12C与13C互为同位素D.13C核外电子数大于核内质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时三种弱酸的电离平衡常数:
化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因____________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为____________。
(3)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为________________,解释混合溶液呈碱性的原因_________________________________。
(4)写出NaA溶液中通少量CO2的离子方程式_______________________________________。
(5)某同学用Na2CO3和NaHCO3溶液进行如下图所示实验:

① 充分反应后a试管中大量存在的离子是_______________________________________。
② 用离子方程式表示b试管中发生的反应_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
(1)仪器a的名称为______________,仪器b的作用是______________。
(2)装置A中生成NaClO2的离子方程式为____________________________。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、降温结晶、过滤 _____干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)B中现象为____________________________________ 。
(5)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学在实验室用卤块制备少量Mg(ClO3)2·6H2O,其流程如图所示:
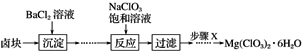
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)的变化曲线如图所示。

③形成氢氧化物沉淀时,不同离子对应溶液的pH如下:Fe2+开始沉淀的pH为5.8,完全沉淀的pH为8.8;Fe3+开始沉淀的pH为1.1,完全沉淀的pH为3.2;Mg2+开始沉淀的pH为8.2,完全沉淀的pH为11。
④可选用的试剂:H2O2、稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
(1)步骤X包含的操作为___________、 ___________、____________、过滤洗涤并干燥。
(2)加入BaCl2溶液沉淀后需经过两步实验步骤才进行下步反应,请写出这两步实验步骤:
①________________________________________________________________________;
② _______________________________________________________________________;
(3)加入NaClO3饱和溶液发生反应的化学方程式为_______________________________。
(4)将Mg(ClO3)2加入到含有KSCN的FeSO4溶液中立即出现红色,写出相关反应的离子方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com