
分析 (1)根据c=$\frac{n}{V}$计算出所得盐酸的物质的量浓度;
(2)根据m=ρV计算出溶液质量,然后根据质量分数的表达式计算;
(3)根据H元素质量守恒定律计算出需要HCl的物质的量,然后根据V=$\frac{n}{c}$计算需要该盐酸体积.
解答 解:(1)标准状况下4.48LHCl的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,所得盐酸的浓度为:$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:2mol/L;
(2)若盐酸的密度为0.73g/cm3,则该100mL盐酸的质量为:0.73g/cm3×100mL=73g,0.2molHCl的质量为:36.5g/mol×0.2mol=7.2g,则该盐酸的质量分数为:$\frac{7.3g}{73g}$×100%=10%,
故答案为:10%;
(3)标准状况下4.48L氢气的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,生成0.2mol氢气需要消耗HCl的物质的量为0.4mol,
则需要该盐酸的体积为:$\frac{0.4mol}{4mol/L}$=0.1L=100mL,
故答案为:100.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积、物质的量浓度之间的关系为解答关键,注意掌握质量分数、物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物,X可以显负价,Y显正价 | |
| B. | 第一电离能可能Y小于X | |
| C. | 最高价含氧酸的酸性:X对应的最高价含氧酸酸性弱于Y对应的最高价含氧酸的酸性 | |
| D. | 气态氢化物的稳定性:HmY小于HmX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”释放的甲烷属于烃 | |
| B. | “可燃冰”的分解与释放,可能会诱发海底地质灾害,加重温室效应 | |
| C. | “可燃冰”将成为人类的后续能源 | |
| D. | “可燃冰”是水变的油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| B. | 硫酸和氢氧化铜溶液混合:H++OH-═H2O | |
| C. | 石灰石中加入稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸和氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸的电离方程式:H2SO3?2H++SO32- | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式: | |
| D. |  互为同系物 互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关于PHB的叙述中不正确的是( )
,下列关于PHB的叙述中不正确的是( )| A. | 它能发生水解反应 | |
| B. | 它在微生物作用下可降解成CO2和水 | |
| C. | 它可能是由一种含羟基的羧酸经缩聚反应而得 | |
| D. | 制备它的单体为HCOOH和CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
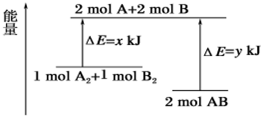
| A. | 该反应是吸热反应 | |
| B. | 断裂 1mol A-A 键和 1mol B-B 键能放出xkJ 的能量 | |
| C. | 断裂 2mol A-B 键需要吸收ykJ 的能量 | |
| D. | 2mol AB 的总能量高于 1 mol A2和 1mol B2的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com