
| A. | 2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ/mol | B. | 2H2(g)+O2(g)═2H2O(1)△H=+571.6 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol |
分析 1gH2燃烧生成液态水时放出142.9kJ的热量,1molH2燃烧放出的热量为285.8kJ,根据热化学方程式应注明聚集状态、反应热的数值、单位、符号,其化学计量数表示该物质的物质的量来书写.
解答 解:1gH2燃烧生成液态水时放出142.9kJ的热量,1molH2燃烧放出的热量为285.8kJ,燃烧热表示1mol可燃物完全燃烧生成稳定氧化物放出的热量,则H2燃烧热的热化学方程式应为:H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol;
故选D.
点评 本题考查热化学方程式的意义和书写,题目难度不大,注意热化学方程式的书写方法,燃烧热表示1mol可燃物完全燃烧生成稳定氧化物放出的热量.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:实验题
| 实验 序号 | 起始温度t1/℃ | 终止温度 (t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
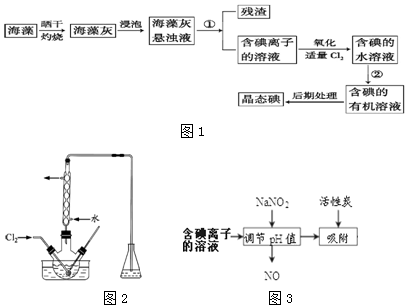
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都含有碳、而且碳原子有四个价电子,碳原子间以及碳与其他原子间结构多样 | |
| B. | 它们反应很复杂 | |
| C. | 制取它们的方法很多 | |
| D. | 它们都是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、H2SO4、MgCl2 | B. | NaCl、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com