
| A. | 该未知物X为NaI | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为5:2 | |
| C. | 该反应中,发生氧化反应的过程是KIO3→I2 | |
| D. | 由反应可知还原性强弱顺序为:Na2SO3>I2 |
分析 所给物质中存在不同化合价的物质为KIO3、Na2SO3、I2、K2SO4,因还原性Na2SO3>I2,则反应KIO3、Na2SO3为反应物,I2、K2SO4和未知物X为产物,结合质量守恒可知反应的方程式应为2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O,则X为Na2SO4,以此解答该题.
解答 解:反应的方程式应为2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O,
A.Na2SO3 被氧化生成X为Na2SO4,故A错误;
B.氧化剂是KIO3 ,而还原剂是Na2SO3 物质的量之比为2:5,故B错误;
C.KIO3→I2的过程I元素化合价降低,发生还原反应,故C错误;
D.氧化还原反应中还原剂的还原性大于还原产物的还原性,还原性强弱顺序为:Na2SO3>I2,故D正确.
故选D.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,根据元素化合价变化来分析解答即可,根据得失相等进行配平即可,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 纳米铁粉可以高效地去除被污染水体的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 | |
| C. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线 | |
| D. | Ba2+浓度较高时危害健康,但BaSO4可服入体内,做为造影剂用于X-射线检查肠胃道疾病 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | 灼热的炭与CO2反应 | ||
| C. | 高温煅烧石灰石 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质微粒的大小与分散系种类的关系: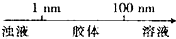 | |
| B. | 常温下溶液的pH其酸碱性的关系: | |
| C. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| D. | Na与O2反应的产物: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$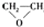 +HOCH2═O═CH2OH+2H2O +HOCH2═O═CH2OH+2H2O | B. | CH2═CH2+Cl2+Ca(OH)2? +CaCl2+H2O +CaCl2+H2O | ||
| C. | CH2═CH2+ (过氧乙酸)? (过氧乙酸)?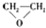 +C3HCOCH +C3HCOCH | D. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$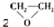 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
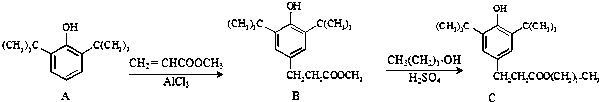
| A. | 物质A中所有碳原子有可能位于同一平面 | |
| B. | 物质B可与4molH2发生加成反应 | |
| C. | 用酸性KMnO4溶液鉴别抗氧化剂C中是否含有CH3(CH2)17OH | |
| D. | B生成C的反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4溶液中,c(NH4+)由大到小的顺序是②>①>④>③ | |
| B. | 常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度大小顺序为:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L(NH4)2Fe(SO4)2溶液:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol/L | |
| D. | 室温下,向0.1 mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com