
【题目】已知:C(s)+O2(g) ![]() CO2(g) ΔH=-437.3 kJ·mol-1;2CO(g)+ O2(g)
CO2(g) ΔH=-437.3 kJ·mol-1;2CO(g)+ O2(g) ![]() 2CO2(g) ΔH=-566.0 kJ·mol-1
2CO2(g) ΔH=-566.0 kJ·mol-1
(1)一氧化碳的标准燃烧热ΔH为:_________
(2)碳和氧气反应生成一氧化碳的热化学方程式是:___________
(3)反应CO2(g) + C(s)![]() 2CO(g) ΔH为:_________________
2CO(g) ΔH为:_________________
(4)完全燃烧相同物质的量的C和CO,放出的热量_____多(填C或CO)
(5)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式________
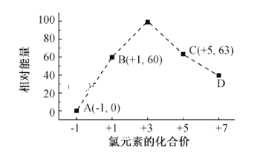
(6)一定条件下,在水溶液中1 mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图 所示。B→A+C反应的热化学方程式为(用离子符号表示)___________
【答案】-283kJ·mol-1 2C(s)+O2(g) ![]() 2CO(g) ΔH=-308.6 kJ·mol-1 128.7kJ·mol-1 C CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol 3ClO-(aq)= ClO3-(aq)+2Cl- (aq) ΔH=-117 kJ·mol-1
2CO(g) ΔH=-308.6 kJ·mol-1 128.7kJ·mol-1 C CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol 3ClO-(aq)= ClO3-(aq)+2Cl- (aq) ΔH=-117 kJ·mol-1
【解析】
根据燃烧热的概念及热化学方程式的含义计算燃烧热;根据盖斯定律计算反应热并书写热化学方程式;根据图示中反应物总能量与生成物总能量的相对大小计算反应热并书写热化学方程式。
(1)在25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,根据题干中的热化学方程式知,一氧化碳的标准燃烧热ΔH=![]() =283kJ·mol-1;故答案为:-283kJ·mol-1;
=283kJ·mol-1;故答案为:-283kJ·mol-1;
(2)根据盖斯定律得:I C(s)+O2(g) = CO2(g) ΔH=-437.3 kJ·mol-1;II 2CO(g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1 ,I×2-II得2C(s)+O2(g) =2CO(g) ΔH=(-437.3 kJ·mol-1)×2-(-566.0 kJ·mol-1)=-308.6 kJ·mol-1,即热化学方程式为:2C(s)+O2(g) = 2CO(g) ΔH=-308.6 kJ·mol-1,故答案为:2C(s)+O2(g) = 2CO(g) ΔH=-308.6 kJ·mol-1;
(3)根据盖斯定律得:I C(s)+O2(g) = CO2(g) ΔH=-437.3 kJ·mol-1;II 2CO(g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1 ,I-II得CO2(g) + C(s)![]() 2CO(g) ΔH=-437.3 kJ·mol-1+566.0 kJ·mol-1=128.7kJ·mol-1,故答案为:128.7kJ·mol-1;
2CO(g) ΔH=-437.3 kJ·mol-1+566.0 kJ·mol-1=128.7kJ·mol-1,故答案为:128.7kJ·mol-1;
(4)C与氧气反应生成CO时放热,CO与氧气反应生成CO2时也放热,所以完全燃烧相同物质的量的C和CO时都生成CO2,放出的热量C多,故答案为:C;
(5)8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则1molCH4燃烧时放出的热量为445.15kJ×2=890.3kJ,则热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=890.3kJ/mol,故答案为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=890.3kJ/mol;
(6)结合Cl元素的化合价可知B→A+C反应为3ClO=ClO3+2Cl,生成1molC时能量变化为3×60kJ63kJ0=117kJ,反应物总能量大于生成物总能量,该反应放出117kJ热量,热化学反应方程式为:3ClO-(aq)= ClO3-(aq)+2Cl- (aq) ΔH=-117 kJ·mol-1,故答案为:3ClO-(aq)= ClO3-(aq)+2Cl- (aq) ΔH=-117 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:

(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在工农业生产和日常生活中都有着重要的应用.下列叙述不正确的是![]()
A.长期使用![]() 化肥会使土壤酸化,而过度使用尿素
化肥会使土壤酸化,而过度使用尿素![]() 会使土壤碱化
会使土壤碱化
B.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
C.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质
D.“酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
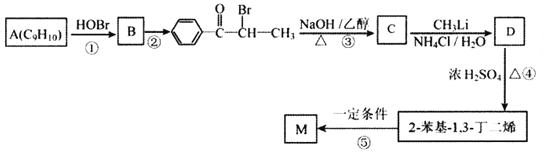
【题目】M(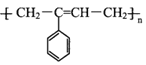 )是一种高分子化合物,它的合成路线如图所示:
)是一种高分子化合物,它的合成路线如图所示:
已知:①R-CH=CH2![]() R-CH(OH)CH2Br
R-CH(OH)CH2Br
②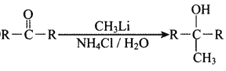
回答下列问题:
(1)反应①的反应类型为__________,D中的官能团名称是__________。
(2)A的名称是__________(系统命名法)。
(3)反应②的条件为__________;反应③的化学方程式为__________。
(4)H为B的同分异构体,满足下列条件的结构共有__________种(不含立体异构);其中核磁共振氢谱中出现4组峰,且峰面积之比为6:2:2:1的是__________ (写出结构简式)。
i.苯环上有两个取代基;ⅱ.与FeCl3溶液发生显色反应。
(5)参照上述合成路线,以![]() 为原料(其他原料任选)制备
为原料(其他原料任选)制备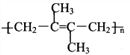 ,请设计合成路线__________。
,请设计合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数,下列说法正确的是( )
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=![]()
C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玉溪一中某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。

已知:298 K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 ,回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为________,固体A为________(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式_________________。
(3)调节pH至2.9~3.2的目的是分离________(填离子符号)。
(4)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_____________________。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为____________(填化学式)。
(6)红棕色固体C的用途____________________(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知浓硝酸和乙胺反应:![]() ,产物
,产物![]() 的熔点为
的熔点为![]() ,在室温下能够融化电离出
,在室温下能够融化电离出![]() 和
和![]() 离子,称为室温离子.下列有关正确的是
离子,称为室温离子.下列有关正确的是![]()
A.浓硝酸和乙胺反应属于加成反应
B.室溫离子可以使熔盐燃料电池在常溫下工作
C.![]() 中,只有
中,只有![]() 键没有
键没有![]() 键
键
D.融化![]() 晶体需要破坏分子间作用力
晶体需要破坏分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________。
(2)工业上常用CO和H2合成甲醇,反应方程式为:CO(g) +2H2(g)![]() CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。
CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。

①当起始n(H2)/n(CO)=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=________。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH(g),达新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图像中的____点(填“D”“E”或“F”)。
③由图2可知该反应的ΔH________0(填“>”“<”或“=”),理由是______________;当压强为p2时,在y点:v正________v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol·L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-,②Cr2O72-还原产物为Cr3+。
请回答下列问题:
(1)写出Cr(OH)3溶于NaOH的离子方程式___。
(2)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___。
(3)常温下,向50mL0.005mol·L1的Cr2(SO4)3溶液中加入0.24mol·L1的NaOH溶液50mL,充分反应后,溶液pH为___。
(4)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100mL滤液;
Ⅱ.用cmol·L1的标准KMnO4酸性溶液滴定bmL一定浓度的FeSO4溶液,消耗KMnO4溶液bmL;
Ⅲ.取bmL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗dmLFeSO4溶液。
①步骤Ⅱ中的滴定过程应选用___(填“酸式”或“碱式”)滴定管。
②写出步骤Ⅱ中离子反应方程___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com