
| A. | CH3COOH | B. | HOOC-COOH | C. | HO(CH2)2CHO | D. | HOC6H4COOH |
分析 M能与钠反应的有机物可能含有-OH或-COOH或-OH和-COOH,能与Na2CO3溶液反应放出气体,有机物M含有-COOH.质量相等的有机物M,物质的量相等,生成的氢气的体积大于二氧化碳的体积,则说明M中还含有-OH,据此结合选项判断.
解答 解:-OH、-COOH都能与金属钠反应生成H2,1mol-OH或1mol-COOH与钠反应可产生0.5mol H2,仅-COOH与Na2CO3反应生成CO2,1mol-COOH与Na2CO3反应可产生0.5mol CO2,题目中有机物与金属钠反应产生的气体的体积多于与纯碱反应产生的气体的体积,则有机物结构中既有-COOH又有-OH,只有D符合,
故选D.
点评 本题考查有机物的结构和性质,题目难度不大,注意-COOH可与Na2CO3反应生成气体,而-OH不与Na2CO3反应,HO-COOH为碳酸(不属于有机物).


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 解释 |
| A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
| C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子且苯与水不互溶 |
| D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 英文的“中国”(China)又指“瓷器”,中国很早就应用化学技术制作陶瓷 | |
| B. | “四大发明”之一黑火药是由硫黄、硝石、木炭三种物质按一定比例配制的混合物 | |
| C. | 《淮南万毕术》中有“曾青得铁则化为铜”的记载,其含义是铁可从铜盐溶液中置换出铜 | |
| D. | 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 加硝酸后的白色沉淀不一定是BaSO4 | |
| D. | 此实验不能确定Na2SO3是否部分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
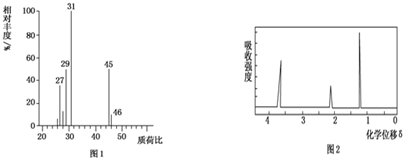
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 4NH3+6NO$?_{△}^{催化剂}$5N2+6H2O | D. | NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com