
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
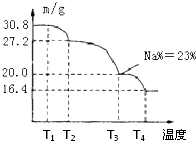 硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.
硼是一种重要的非金属元素,单质硼可以通过硼镁矿Mg2B2O5?H2O来制取.查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市高二上学期期末统考化学试卷(解析版) 题型:填空题
研究化学反应中的能量变化有重要意义。请根据学过知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:
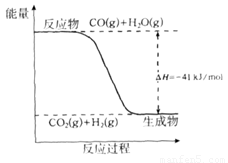
①反应的热化学方程式为____________________________________________。
②已知: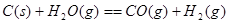
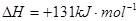
则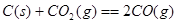
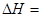
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1; N-H键的键能是391.55 kJ·mol-1。则1/2N2(g) + 3/2H2(g) == NH3(g) ΔH = 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
过氧乙酸(C2H4O3)是一种消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① 2MnO4-+5H2O2+6H+===2Mn2++5O2十8H2O
② H2O2+2![]() +2H+=== I2+2H2O
+2H+=== I2+2H2O
③ C2H4O3+2![]() +2H+===CH3COOH+I2+H2O
+2H+===CH3COOH+I2+H2O
④ 2 S2O32-+I2 ==== S4O62-+2I-
取20mL待测液,用硫酸使溶液酸化,再用浓度为1mol?![]() 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为20mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为20mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取20 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为3 mol?![]() 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为60mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为60mL。
(1)已知过氧乙酸分子部分含有与H2O2相同的“结构”,则其结构简式为 。
(2)用KMnO4滴定H2O2中,滴定终点的颜色变化是_____________________
(3)当加入的KI的质量 (填写选择序号)时,可不影响测定过氧乙酸的浓度c0。(多选或少选均不给分)
A.少量需要准确称量 B.少量不需要准确称量
C. 过量需要准确称量 D. 过量不需要准确称量
(4)根据上述实验数据,计算过氧乙酸物质的量浓度(写出主要步骤)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com