
分析 当滴至20mL时开始产生沉淀,此时溶液是氯化钠和偏铝酸钠溶液,根据组成n(NaOH)=4n(AlCl3)+n(HCl)=4×20×2×10-3+20×2×10-3=0.2mol,
(1)根据c=$\frac{n}{V}$进行分析求解;
(2)使产生的沉淀刚好消失,铝转化为氯化铝,则相当于加入盐酸与原溶液中的氢氧化钠反应,由此分析解答.
解答 解:当滴至20mL时开始产生沉淀,此时溶液是氯化钠和偏铝酸钠溶液,根据组成n(NaOH)=4n(AlCl3)+n(HCl)=4×20×2×10-3+20×2×10-3=0.2mol,
(1)c=$\frac{n}{V}$=$\frac{0.2mol}{4mol•{L}^{-1}}$=50mL,
答:原来氢氧化钠溶液的体积是50mL;
(2)使产生的沉淀刚好消失,铝转化为氯化铝,则相当于加入盐酸与原溶液中的氢氧化钠反应,V(HCl)=$\frac{0.05L×4mol•{L}^{-1}}{2mol•{L}^{-1}}$=100mL,
答:若再滴加2mol•L-1的盐酸使产生的沉淀刚好消失,需加100mL.
点评 本题考查混合物反应的计算,侧重考查学生分析解决问题能力,题目难度中等,利用守恒思想进行解答,可以简化计算过程,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 1.0 | 2.0 | 0 |
| 2 | 0.8 | 0.2 | |
| 4 | 1.0 | 0.5 | |
| 6 | 1.0 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | P H=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 | |
| D. | 25℃时,向0.1mol•L-1CH3COOH溶液滴加氨水,c(H+)/c(CH3COOH)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用1体积酒精和3体积浓度为6mol/L的硫酸制乙烯 | |
| B. | 用镁粉和空气反应制备Mg3N2 | |
| C. | 2mL10%的NaOH溶液中滴加2%的CuSO4溶液5滴得新制Cu(OH)2悬浊液 | |
| D. | 用电解熔融氯化铝的方法制得单质铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
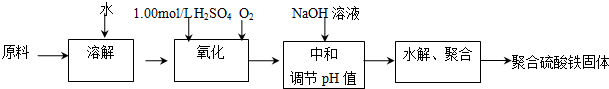
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热水溶解纯碱能够提高去油污的效果 | |
| B. | 配制氯化铁溶液时滴加几滴稀盐酸可以防止氢氧化铁形成 | |
| C. | 硫酸铵和草木灰混合施用到农田可以增强肥效 | |
| D. | 盐碱地(含NaCl、Na2CO3)施加适量石膏可以降低土壤的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| D | 向水玻璃溶液中通入足量CO2 后,产生白色浑浊 | 生成了硅酸沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com