
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | F | G | I | |||
| 3 | B | C | H |
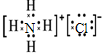 .
. →
→ .
. 分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为O,G为F,H为Cl,I为Ne,
(1)稀有气体的性质稳定;
(2)短周期中F的非金属性最强,Na的金属性最强,一般熔点为离子晶体>分子晶体;
(3)非金属性越强,最高价氧化物的水化物酸性越强;
(4)HF中含氢键,沸点高;
(5)A、E、H组成的常见物质为氯化铵;
(6)E的氢化物为氨气,为共价化合物.
解答 解:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为O,G为F,H为Cl,I为Ne,
(1)以上元素中,只有Ne的最外层电子为8,为稳定结构,则化学性质不活泼,故答案为:Ne;
(2)F的非金属性最强,Na的金属性最强,二者形成离子化合物NaF,该物质的熔点比干冰的熔点高,故答案为:NaF;高;
(3)非金属性越强,最高价氧化物的水化物酸性越强,则酸性为HNO3>H2CO3,故答案为:HNO3>H2CO3;
(4)G、H的氢化物沸点较高的是HF,理由是HF分子间含氢键,故答案为:HF;HF分子间含氢键;
(5)A、E、H组成的常见物质为氯化铵,其电子式为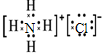 ,故答案为:
,故答案为: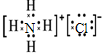 ;
;
(6)E的氢化物为氨气,为共价化合物,用电子式表示形成过程为3H•+ →
→ ,故答案为:3H•+
,故答案为:3H•+ →
→ .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
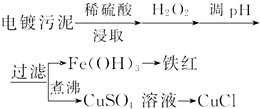
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 因为电离过程是吸热过程,所以温度越高,同一弱电解质的电离平衡常数越大,电离度越小 | |
| B. | 弱电解质的电离平衡常数是由各微粒的平衡浓度表达的,所以弱电解质的电离平衡常数只与浓度有关 | |
| C. | 对于不同的弱酸,电离平衡常数越大,酸性一定越强,可以通过电离平衡常数的大小判断弱酸的相对强弱 | |
| D. | 弱电解质的电离平衡常数是衡量弱电解质电离程度大小的一种方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
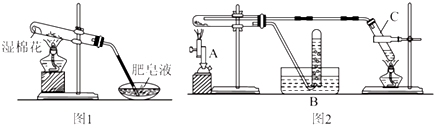
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后的黑色粉末X(假定成分分布均匀)取出少量,放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.35mol•L-1•min-1 | D. | vD=0.02mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com