
短周期元素A、B、C、D最高价氧化物对应水化物分别为W、X、Y、Z,A是短周期中原子半径最大的元素,常温下W、Y、Z均可与X反应,A、C、D的原子序数及0.1 mol/LW、Y、Z溶液的pH如图所示。下列说法正确的是
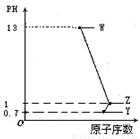
A.B的离子半径大于A的离子半径
B.C氢化物稳定性大于D氢化物稳定性
C.W、Z两物质含有的化学键类型相同
D.B原子的电子层数与最外层电子数相等
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
下列物质中,只含有非极性共价键的是( )
A.Na2O2 B.KCl C.H2S D.N2
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第八次模拟理综化学试卷(解析版) 题型:选择题
下列关于实验的叙述,正确的是( )
A.滴定管的润洗是向滴定管中加入少量要盛装的溶液,边旋转边倾斜使溶液润湿全部内壁后从上口倒出
B.中和热的测定需要使用两个量筒分别量取酸碱溶液体积,使用两个温度计分别测定开始和终点的溶液温度
C.用密度为1.84g/cm3的浓硫酸配制100mL的2mol/L的稀硫酸,需要计算并称量浓硫酸的质量
D.用重结晶法提纯粗苯甲酸时,溶解度较小的杂质趁热过滤时留在了滤纸上,溶解度较大的杂质冷却结晶时留在了母液里
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第二次模拟理综化学试卷(解析版) 题型:选择题
科学家开发出一种新型锂—氧电池,能量密度极高,效率达90%以上。电池中添加碘化锂(LiI)和微量水,工作原理如图,总反应为:O2+4LiI+2H2O 2I2+4LiOH。对于该电池的说法不正确的是
2I2+4LiOH。对于该电池的说法不正确的是
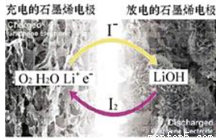
A.放电时负极上I-被氧化
B.充电时Li+从阳极区移向阴极区
C.充电时阴极反应为LiOH+e-= Li+OH-
D.放电时正极反应为O2+2H2O+4Li++4e-= 4LiOH
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:实验题
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
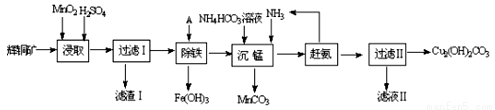
①浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2和 (写化学式)。
②“除铁”这一步反应在25℃进行,加入的试剂A为__________,若加A后溶液的PH调为4,溶液中Fe3+离子浓度为 mol/L。(已知Ksp[Fe(OH)3]= 4.0×10-38)
③“沉锰”(除Mn2+)过程中反应的离子方程式 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了_____ mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则乙池电解质溶液的质量与实验前的电解质溶液的质量差△m= g。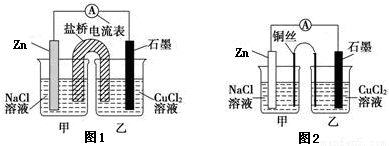
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图2所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH___(填“减小”、“增大”或“不变”) ,乙池中石墨为_____极(填“正”、“负”、“阴”或“阳”) 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:填空题
阅读下表中短周期主族元素的相关信息并填空。
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是其内层电子数的三倍 |
C | 是地壳中含量最高的金属元素 |
D | A、B、D组成的化合物X是84消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
(1)E元素周期表中的位置 ;C的原子结构示意图 。
(2)X的化学式为 。
(3)A、B、D三种元素形成的简单离子半径由大到小的顺序为 (用离子符号表示)。
(4)A、B形成的一种原子个数比为1:1化合物的化学式为 。
(5)A在真空高压下能与由元素D、E组成化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
已知:①1mol H2分子中化学键断裂时需要吸收436KJ的能量;②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量;③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量,对于反应:H2(g)+Cl2(g)=2HCl(g),下列叙述正确的是
A.反应生成2mol氯化氢气体,吸收248KJ的能量
B.反应生成2mol氯化氢气体,放出183KJ的能量
C.反应物的总能量低于生成物的总能量
D.该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.Na+的半径大于F-的半径
C.F-,Na+,Mg2+,Al3+是与He原子具有相同电子层结构的离子
D.NH4+与H3O+具有相同的质子数和电子数
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一下第一次月考化学试卷(解析版) 题型:实验题
某同学对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| (1)溶液出现浑浊,并变为黄绿色;(2)稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 ________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________。
(3)现象(1)中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分ClO-和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是_____________________。并写出漂白精有效成分ClO-和Cl-反应的离子方程式: 。
(4)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象(2)中黄绿色褪去的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com