
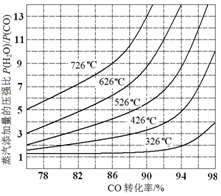
 实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:
实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,回答下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)根据平衡常数的表达式推断;由盖斯定律△H3=△H1+△H2;
(2)温度升高K值减小,所以正反应为放热反应;令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算;
(3)将化学平衡常数中的浓度c换成压强P就可以得到KP.
解答 解:(1)根据化学方程式可知K1=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$,K2=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$,K3=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$,所以:K3=K1×K;由盖斯定律△H3=△H1+△H2,所以△H3=(a+b) kJ/mol,故答案为:K3=K1×K2;(a+b) kJ/mol;
(2)温度升高K值减小,所以正反应为放热反应,
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以$\frac{c×c}{(0.02-c)(0.02-c)}$=9,解得c=0.015,
所以CO的转化率为$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:放热;75%;
(3)CH4(g)+H2O(g)?CO(g)+3H2(g),对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$,故答案为:$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$.
点评 本题考查化学平衡常数、平衡移动相关计算等,题目较为综合,涉及多方面的知识,难度中等,注意把握等效平衡的解题应用.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 试验操作和现象 | 结论 |
| A | 向浓度均为0.1mol.L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 室温下,实验测得:0.1mol.L-1Na2CO3溶液的PH约为11.6;0.1mol.L-1NaHCO3溶液的PH约为7.9 | CO32-结合H+的能力比HCO3-的强 |
| D | 某盐酸溶液中滴加盐酸,产生无色无味气体,将气体通入澄清石灰水变浑浊 | 该盐一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
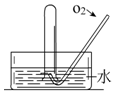 如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOCH2CH3 | B. | HCOOH | C. | HOOCCOOH | D. | HCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
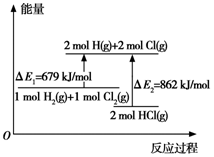
| A. | △E1是该反应的活化能 | B. | △E2是2 mol H-Cl键的总键能 | ||
| C. | 加入催化剂可以改变反应的焓变 | D. | 该反应是一个放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com