
����Ŀ��Ǧ���صĹ���ԭ��ΪPb+PbO2+4H++2SO ![]()
![]() 2PbSO4+2H2O����ͼ��ʾװ���У�AΪPbO2�缫��BΪPb�缫��E��F��ΪPbSO4�缫��U�ι���ʢ������������Һ���ȱպ�S1�㹻��ʱ���Ͽ�S1 �� �����й�˵���в���ȷ���ǣ� ��
2PbSO4+2H2O����ͼ��ʾװ���У�AΪPbO2�缫��BΪPb�缫��E��F��ΪPbSO4�缫��U�ι���ʢ������������Һ���ȱպ�S1�㹻��ʱ���Ͽ�S1 �� �����й�˵���в���ȷ���ǣ� �� 
A���պ�S1ʱ�����U�ι�Ϊԭ��أ��Ҳ�U�ι�Ϊ���أ�F�缫����������
B��������U�ι��е���Һ��ϣ����Һ������������Ϊ30%
C�����ٵ����պ�S2 �� �缫
A.B�������������ӣ��缫
B.F����������С
C.���ٵ����պ�S2 ��
D.F�缫�Ϸ����ķ�Ӧ��֮ǰ��ͬ
���𰸡�A
���������⣺A���ȱպ�S1�㹻��ʱ�䣬���Ϊԭ��أ�AΪ������EΪ������FΪ�������缫����ʽΪPbSO4��2e��+2H2O=PbO2+SO ![]() +4H+ �� û���������ɣ���A���� B���պ�S1ʱ������Pb+PbO2+4H++2SO
+4H+ �� û���������ɣ���A���� B���պ�S1ʱ������Pb+PbO2+4H++2SO ![]() =2PbSO4+2H2O������������ᣬ�Ҳ��2PbSO4+2H2O
=2PbSO4+2H2O������������ᣬ�Ҳ��2PbSO4+2H2O ![]() Pb+PbO2+4H++2SO
Pb+PbO2+4H++2SO ![]() ���Ҳ��������ᣬ����U�ι��е���Һ��ϣ����Һ������������Ϊ30%����B��ȷ��
���Ҳ��������ᣬ����U�ι��е���Һ��ϣ����Һ������������Ϊ30%����B��ȷ��
C�����ٵ����պ�S2 �� �缫A����PbSO4��2e��+2H2O=PbO2+SO ![]() +4H+ �� B����Pb+SO
+4H+ �� B����Pb+SO ![]() -2e���TPbSO4 �� �����������ӣ�E�����缫����ʽΪPbSO4+2e��=Pb+SO
-2e���TPbSO4 �� �����������ӣ�E�����缫����ʽΪPbSO4+2e��=Pb+SO ![]() ��F����PbSO4��2e��+2H2O=PbO2+SO
��F����PbSO4��2e��+2H2O=PbO2+SO ![]() +4H+ �� �缫E��F����������С����C��ȷ��
+4H+ �� �缫E��F����������С����C��ȷ��
D���պ�S1ʱ��EΪ������FΪ������������ӵ�Դʱ��EΪ������FΪ������������Ӧ��ͬ����D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ͬ��ͬѹ�£�ͬ�����H2��CO2���ʵ���֮��Ϊ__________���ܶ�֮��Ϊ______��
(2)��NAΪ�����ӵ���������ֵ�����a g�����к��еķ�����Ϊb����c g�����ڱ�״���µ����Լ��__________L(�ú�NA��ʽ�ӱ�ʾ)��
(3)����100 mL1mol��L��1��ϡH2SO4��Һ����Ҫ����Ͳ��ȡһ�������ŨH2SO4(�ܶ�Ϊ1.84 g��mL��1����������Ϊ98%)�����Т�10mL����50mL����100mL���ֹ�����Ͳ��Ӧѡ�õ���Ͳ��________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼����þ[MgaAlb(OH)c(CO3)d]��һ�������µ�ת������ͼ��ʾ������˵����ȷ����
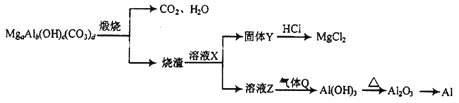
A. Q����ΪNH3
B. X����ΪNaOH
C. a��b��c��d���Ϲ�ϵʽ:2a+3b=c+2d
D. ��ҵ����CO��ԭAl2O3�ķ�����ȡ����Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4����һ����Ҫ����Դ��Ҳ��һ����Ҫ�Ļ���ԭ�ϡ�
(1)����ĽṹʽΪ________
(2)������·ֽ�����������̼�����ܱ������н��д˷�ӦʱҪͨ����������ʹ���ּ���ȼ�գ���Ŀ����_________��
(3)��CH4Ϊȼ�Ͽ���Ƴɽṹ������ת���ʸߡ��Ի�������Ⱦ��ȼ�ϵ�أ��乤��ԭ����ͼ��ʾ����ͨ��a����ĵ缫����Ϊ_____,ͨ��b����ĵ缫��Ӧʽ_______.(���ӽ���Ĥֻ����H+ͨ��)

(4)��һ���¶Ⱥʹ��������£�CH4��CO2��ֱ��ת�������ᣬ����ʵ�֡����š���һ���о�����
���ڲ�ͬ�¶��£������Ĵ�Ч���������������������ͼ��ʾ����÷�Ӧ������¶�Ӧ������_________���ҡ�
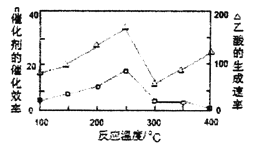
�ڸ÷�Ӧ��������Ч�ɷ�Ϊƫ������ͭ(CuAlO2,������)����CuAlO2�ܽ���ϡ���������������β��ų�NO���壬�����ӷ���ʽΪ_________
(5)CH4��ԭ���Ǵ���NOx�����һ�ַ�������֪һ��������CH4��NOx��Ӧת��ΪN2��CO2,����״����8.96LCH4�ɴ���22.4LNOx,��xֵΪ________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�顣������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯����

(1)����A������Ϊ_____�������D������Ϊ__________��
(2)��Ҫ֤���ǽ�����:Cl>I,��A�м�Ũ���ᣬB�м�KMnO4(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ��۵⻯�ػ����Һ���۲쵽C����Һ____(������)������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�����____��Һ����β����
(3)��Ҫ֤���ǽ�����:C>Si,����A�м����ᡢB�м�CaCO3��C�м�Na2SiO3��Һ���۲쵽C����Һ_______(������)������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ���C�и������飬Ӧ����װ�ü�����װ��______��Һ��ϴ��ƿ��ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ���������ǣ� ��
A. pH=1����Һ�У�Fe2+��NO![]() ��SO
��SO![]() ��Na+
��Na+
B. ��ʹ��̪������Һ�У�Na+��K+��NO![]() ��CO
��CO![]()
C. pH=13����ɫ��Һ�У�Cu2+��NO![]() ��HCO3����Al3+
��HCO3����Al3+
D. c(Fe3+)=0.1 molL-1����Һ�У�K+��CO![]() ��I����SCN��
��I����SCN��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A. 0.1 mol ��![]() ������0.6NA������
������0.6NA������
B. 7.1g Cl2ͨ��������NaOH��Һ�У���Ӧת�Ƶ��ӵ���ĿΪ0.2NA
C. ��״���£�1.12L ��SO3������ԭ����ĿΪ0.2NA
D. ��������MnO2�뺬HCl 4 mol��Ũ�����Ϻ��ּ��ȣ����ɵ����������ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��101kPaʱ������������ȼ�������Ȼ�������������仯���������й�˵���в���ȷ���ǣ� �� 
A.1 molH2�еĻ�ѧ������ʱ��Ҫ����436 kJ����
B.2 molHCl�����еĻ�ѧ���γ�ʱҪ�ͷ�862 kJ����
C.�˷�Ӧ���Ȼ�ѧ����ʽΪ��H2��g��+Cl2��g���T2HCl��g����H=+183 kJ/mol
D.�˷�Ӧ���Ȼ�ѧ����ʽΪ�� ![]() H2��g��+
H2��g��+ ![]() Cl2��g���THCl��g����H=��91.5 kJ/mol
Cl2��g���THCl��g����H=��91.5 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ʊ�����ķ������ټ���ϡ�����MnO2������������ϡH2SO4�ʹ���ʯ�Ʊ�������̼������ϡ�����п���Ʊ����������˲��õķ�����(����)
A.ֻ�Т�
B.ֻ�Тٺ͢�
C.ֻ�Т�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com