
| A. | 燃料电池是一种高效、环境友好的新型电池 | |
| B. | 铅蓄电池放电的时候:正极是Pb,负极是PbO2 | |
| C. | 镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 | |
| D. | 原电池正极发生的反应是氧化反应 |
分析 A.燃料电池的产物多为CO2、H2O等,不污染环境;
碱性锌锰干电池为一次电池;
B.铅蓄电池放电的时候,Pb被氧化,为原电池的负极;
C.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池;
D.正极发生还原反应.
解答 解:A.燃料电池有氢氧燃料电池、甲烷燃料电池、乙醇燃料电池等,产物多为CO2、H2O等,不污染环境,故A正确;
B.铅蓄电池放电的时候,Pb被氧化,为原电池的负极,PbO2被还原,为原电池的正极,故B正确;
C.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池,故C正确;
D.正极发生还原反应,故D错误;
故选D.
点评 本题考查常见原电池的组成以及工作原理,题目难度不大,学习中注意常见原电池的组成以及工作原理,注意相关基础知识的积累.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
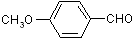 )具有多种同分异构体.
)具有多种同分异构体.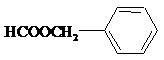 ;②
;②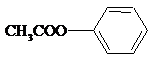 ;③
;③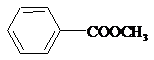 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
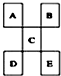
| A. | D一定是金属元素,其金属性比C强 | |
| B. | C的最高价氧化物水化物显强酸性 | |
| C. | B的氢化物是以分子形式存在,且某些分子间存在氢键 | |
| D. | E的原子序数一定是A的5倍,且原子半径比A大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的结构简式CH2CH2CH3 | B. | 四氯化碳的结构式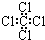 | ||
| C. | 丁烷的结构简式CH3(CH2)2CH3 | D. | 苯的分子式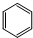 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
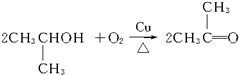 +2H2O)(只写一个)
+2H2O)(只写一个)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3 | B. | Na2O、Na2O2 | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | 1H、2H、3H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
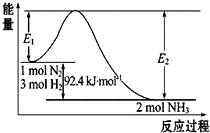 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com