
【题目】某干电池的工作原理如图所示,总反应为:![]() ,下列说法正确的是
,下列说法正确的是
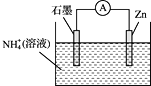
A.石墨为电池的负极
B.电池工作时![]() 被氧化
被氧化
C.实现了电能向化学能转化
D.电子由Zn电极经外电路流向石墨电极
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
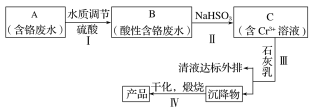
【题目】某铬盐厂净化含Cr(Ⅵ)废水并提取Cr2O3的一种工艺流程如图所示。
已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.6×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2CrO42-![]() Cr2O72-+H2O,B中含铬元素的离子有___(填离子符号)。
Cr2O72-+H2O,B中含铬元素的离子有___(填离子符号)。
(2)当清液中Cr3+的浓度≤1.5mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度=__mg·L-1。
(3)步骤Ⅱ还可用其他物质代替NaHSO3作还原剂。
①若用FeSO4·7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有__(填离子符号)。
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2O72-)的对应关系如下表所示:
pH | 3 | 4 | 5 | 6 |
c(Cr2O72-)/mol·L-1 | 7.02×10-21 | 7.02×10-7 | 1.25×10-3 | 2.21×10-34 |
有人认为pH=6时,c(Cr2O72-)变小的原因是Cr2O72-基本上都已转化为Cr3+。这种说法是否正确,为什么?___。
③用铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种,且各种离子浓度相等。加入铝片,产生H2。下列说法正确的是
A. 向原溶液中加入Cu片发生:3Cu+8H++2NO3-=3Cu2++4H20+2NO↑
B. 向原溶液中加入过量氨水发生:Fe3++H++4NH3·H2O=Fe(OH)3↓+4NH4+
C. 向原溶液中加入过量Ba(OH)2溶液发生:Ba2++20H-+SO42-+NH4++H+=NH3·H2O +BaSO4↓+H2O
D. 向原溶液中加入BaCl2溶液发生:2Ba2++CO32-+SO42-=BaCO3↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,将
时,将![]() 、
、![]() 分别充入两个各为
分别充入两个各为![]() 的密闭容器中,反应过程中浓度变化如下:
的密闭容器中,反应过程中浓度变化如下:![]() ,下列说法正确的是
,下列说法正确的是![]()
容器 | 物质 | 起始浓度 | 平衡浓度 |
Ⅰ |
|
|
|
| 0 |
| |
Ⅱ |
| 0 |
|
|
|
|
A.平衡时,Ⅰ、Ⅱ中反应物的转化率![]()
B.平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]()
C.平衡后,Ⅰ中加入![]() 的
的![]() ,达到新平衡时,反应物的转化率
,达到新平衡时,反应物的转化率![]() 增大
增大
D.平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.Q3+92.4c1=92.4B.α2+α3<1
C.2p1=2p3<p2D.达到平衡时丙容器中NH3的体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用Cl2与KOH溶液反应制备KClO溶液,其装置如下图所示。以KClO溶液及废铁屑等为原料,可制备高效水处理剂聚合硫酸铁![]() 。
。
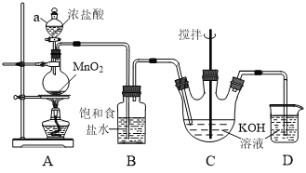
已知:C中反应是放热反应
(1)装置A中仪器a的名称是______;装置B的作用是_______。
(2)Cl2和KOH在较高温度下反应生成KClO3,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是_______(回答一点即可)。
(3)装置D发生反应的离子方程式为______。
(4)聚合硫酸铁![]() (其中Fe元素为+3价)的组成可通过下列实验测定:
(其中Fe元素为+3价)的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁溶于稀盐酸中,往所得溶液中滴加BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
②另称取与①等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
③准确量取25.00 mL溶液B,用0.1000 mol·L-1的KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。该步反应为:![]() 。通过计算确定该聚合硫酸铁的化学式(写出计算过程)。______。
。通过计算确定该聚合硫酸铁的化学式(写出计算过程)。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的合金及其配合物用途非常广泛。
(1) Co3+基态核外电子排布式为________。
(2) 一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为________。

(3) BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________ (用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是________ (已知CO32-的结构式为![]() )。
)。
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________,1 mol该分子中含σ键的数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com