
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =
-49.0 kJ·mol-1,
CH3OH(g)+H2O(g) △H =
-49.0 kJ·mol-1,
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。

(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时CO2的转化率 和该条件下的平衡常数K 。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
(1)> (2)A (3)33.3﹪ K=0.5 (4)升高温度 增大压强。
【解析】
试题分析:(1)反应是从正反应方向开始的。由于在a点时反应还没有达到化学平衡,所以反应速率V(正)>V(逆) (2)反应是在体积固定的密闭容器中进行的,在反应的过程中物质的浓度越大,反应速率越快。由于在开始时反应物的浓度最大,所以在开始不久反应的速率最快。选项为A。(3)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)开始时C(CO2)=3mol/L,C(H2)=4mol/L.
C(CH3OH)=0mol/L, C(H2O)= 0mol/L.当达到化学平衡时C(H2)=1mo/LC(CO2)=2mol/L,C(CH3OH)=1mol/L,C(H2O)=1mol/L.所以CO2的转化率为:(1mol/L÷3mol/L)×100﹪=33.3﹪.此时的化学平衡常数K={ C(CH3OH)·C(H2O)} ÷{ C(CO2)
·C3(H2) } = (1×1)÷(2×13)= 0.5.(4) 仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对于曲线I来说,反应速率加快,达到平衡时n(H2)增多。说明平衡向逆反应方向移动。由于该反应的正反应是个气体体积减小的放热反应,所以要使速率加快,平衡逆向移动,对应的实验条件改变是升高温度 ,对于曲线II来说,反应速率加快,平衡时H2的含量降低。说明改变的外界条件是是速率加快而且平衡正向移动。则对应的实验条件改变是增大压强。
CH3OH(g)+H2O(g)开始时C(CO2)=3mol/L,C(H2)=4mol/L.
C(CH3OH)=0mol/L, C(H2O)= 0mol/L.当达到化学平衡时C(H2)=1mo/LC(CO2)=2mol/L,C(CH3OH)=1mol/L,C(H2O)=1mol/L.所以CO2的转化率为:(1mol/L÷3mol/L)×100﹪=33.3﹪.此时的化学平衡常数K={ C(CH3OH)·C(H2O)} ÷{ C(CO2)
·C3(H2) } = (1×1)÷(2×13)= 0.5.(4) 仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,对于曲线I来说,反应速率加快,达到平衡时n(H2)增多。说明平衡向逆反应方向移动。由于该反应的正反应是个气体体积减小的放热反应,所以要使速率加快,平衡逆向移动,对应的实验条件改变是升高温度 ,对于曲线II来说,反应速率加快,平衡时H2的含量降低。说明改变的外界条件是是速率加快而且平衡正向移动。则对应的实验条件改变是增大压强。
考点:考查化学平衡常数的计算及外界条件对化学反应速率、化学平衡移动一反应物的转化率的影响。


科目:高中化学 来源: 题型:

 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为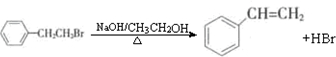
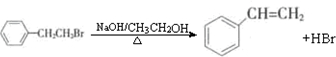


 (任写一种)
(任写一种) (任写一种)
(任写一种) 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法: CH3OH(g)+H2O(g)+49kJ
CH3OH(g)+H2O(g)+49kJ查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com