
已知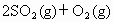
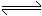
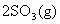 ,实验数据如下表:
,实验数据如下表:

(1)工业生产中应选用的温度________,理由是______________________.
(2)工业生产中应选用的压强______,理由是_______________________.
___________________________________________________.
(3)利用以上数据说明影响化学平衡的因素,我们可以采取什么措施来控制化学反应的限度______________________________________________
_____________________________________________________________.
科目:高中化学 来源: 题型:
| 2 |
| 3 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| 温度/Kn(H2)/n(CO2)CO2转化率/% | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:022
已知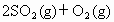
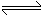
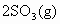 ,实验数据如下表:
,实验数据如下表:

(1)工业生产中应选用的温度________,理由是______________________.
(2)工业生产中应选用的压强______,理由是_______________________.
___________________________________________________.
(3)利用以上数据说明影响化学平衡的因素,我们可以采取什么措施来控制化学反应的限度______________________________________________
_____________________________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com