


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解
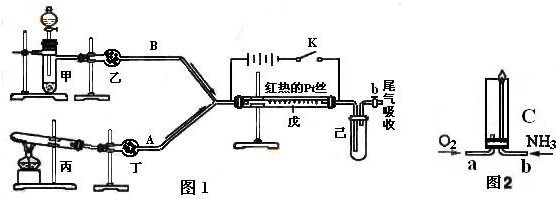
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
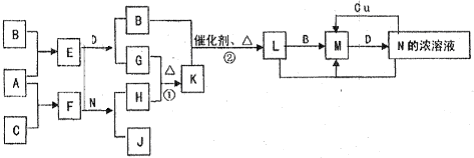


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氧化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
①取1 000 g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
②将待测溶液转移入250 mL锥形瓶中,并加入2—3滴0.2%的X溶液;
③用标准碘溶液滴定待测溶液至终点,消耗21.40 mL标准I2溶液,发生的反应是H3AsO3+I2+H2O——H3AsO4+I-+H+(未配平)
请回答下列问题:
(1)As位于元素周期表中第_________周期第_________族;简述对少量的中草药样品进行前期处理制得待测溶液的方法是_____________________________________。
(2)0.2% X溶液名称是_____________,滴定到终点时锥形瓶中产生的现象是_____________________________________。
(3)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.100 0 g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1 000 mL而制得,请用离子方程式说明标准碘溶液的形成:____________________________________。
(4)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过 2.000 mg/kg,试通过计算说明该中草药样品是否合格。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com