
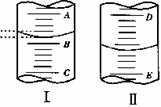
(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是________mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL B.是(50-a)mL
C. 一定大于amL D.一定大于(50-a)mL
科目:高中化学 来源: 题型:阅读理解
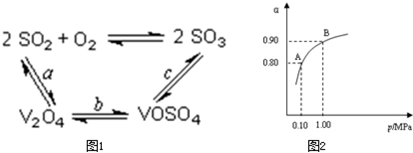
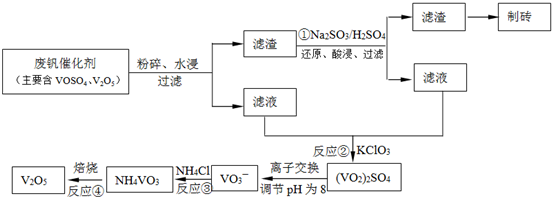
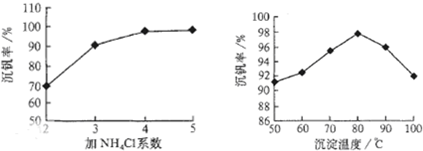
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | / | +3 | +4 | +5 | +7 | +1 | +5 | / |
| 最低价态 | / | / | -2 | / | -4 | -3 | -1 | / | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填写编号) 。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。

(3)元素⑤的某种单质具有平面层状结构,同一层中 的原子构成许许多多的正六边形,此单质与熔融的② 单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年新疆乌鲁木齐一中高三上学期第一次月考化学试题 题型:填空题
下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
/ |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
/ |
|
最低价态 |
/ |
/ |
-2 |
/ |
-4 |
-3 |
-1 |
/ |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填写编号) 。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
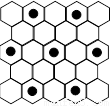
(3)元素⑤的某种单质具有平面层状结构,同一层中 的原子构成许许多多的正六边形,此单质与熔融的② 单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
查看答案和解析>>
科目:高中化学 来源:常州三模 题型:问答题
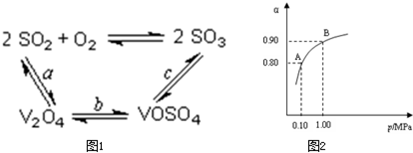
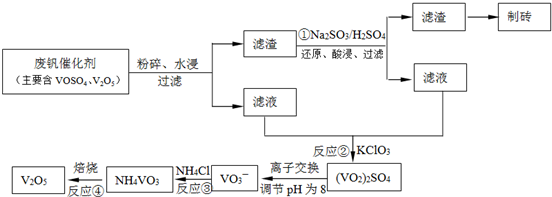
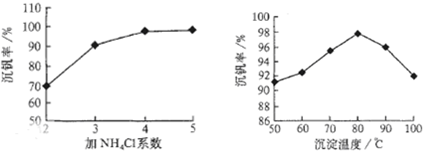
查看答案和解析>>
科目:高中化学 来源: 题型:
(分)下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | / | +3 | +4 | +5 | +7 | +1 | +5 | / |
| 最低价态 | / | / | -2 | / | -4 | -3 | -1 | / | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填写编号) 。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
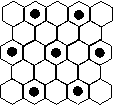
(3)元素⑤的某种单质具有平面层状结构,同一层中 的原子构成许许多多的正六边形,此单质与熔融的② 单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com