
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
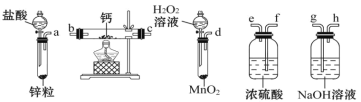
(1)请选择必要的装置,按气流方向连接顺序为_____(填仪器接口的字母编号,装置可重复使用)。
实验步骤如下:
①检验装置的气密性后,装入药品;
②打开分液漏斗活塞通入一段时间气体,加热药品;
③反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;
④拆除装置,取出产物。
(2)一小组同学利用CaCl2在碱性条件下与H2O2反应制得。制备CaO2的实验方案和装置示意图如下:
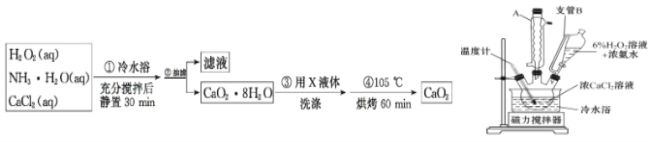
①三颈烧瓶中发生的主要反应的化学方程式为______________________________。
②支管B的作用是_____。
③步骤③中洗涤CaO2·8H2O的液体X 的最佳选择是_____;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
④该反应常用冰水浴控制温度在0℃左右,其可能的原因该反应是放热反应,温度低有利于提高CaO2·8H2O产率;_____。
(3)测定产品中CaO2 含量的实验步骤如下:
步骤一:准确称取a g 产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI 晶体,再滴入少量2 mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴_____(作指示剂)。
步骤三:逐滴加入浓度为 c mol·L-1 的 Na2S2O3 溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3 溶液的体积为V mL。CaO2的质量分数为 _________(用字母表示)。(已知:I2+ 2S2O32-=2I-+ S4O62-)
【答案】dfebcf (或 dfecbf) CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl 平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下 A 温度低可减少过氧化氢的分解,提高过氧化氢的利用率 淀粉溶液 ![]() %
%
【解析】
(1)一般制备纯净干燥的气体的实验装置的顺序为:制备装置→除杂装置→干燥装置等;
(2)过氧化钙制备流程为:CaCl2、H2O2、NH3H2O发生反应,经过抽滤、洗涤得到CaO28H2O,然后在105℃下烘烤得到CaO2。
①根据分析可知,反应物为CaCl2、H2O2、NH3H2O,产物为CaO28H2O,结合质量守恒定律书写化学方程式;
②根据仪器特点和具体实验进行考虑;
③根据过氧化钙的性质选择洗的最佳试剂;
④根据温度对化学反应速率及平衡的影响来考虑;
(3)过氧化钙氧化碘化钾生成碘单质,碘遇淀粉变蓝,故指示剂选淀粉溶液;根据电子转移守恒关系CaO2~I2~2S2O32-计算。
(1)制备过氧化钙时,用双氧水制备氧气,钙属于化学性质非常活泼的金属,极易与水反应生成氢氧化钙和氢气,而制备的氧气中会混有水蒸气,所以在与钙化合之前需要干燥,选用试剂是浓硫酸;同时为防止空气中水蒸气进入,最后还需要连接浓硫酸的洗气瓶,所以正确的顺序为:dfebcf或dfecbf;
(2)①根据制备流程可知,三颈烧瓶中反应物为CaCl2、H2O2、NH3H2O,产物为CaO28H2O,还应该生成NH4Cl,该反应的化学方程式为:CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl;
②支管B联通仪器内部与大气压,能够平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下,答案为:平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下;
③由于过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应,不溶于醇类、乙醚等,所以步骤③中洗涤CaO2·8H2O的液体X的最佳选择是无水乙醇;答案选A;
④利用反应CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl,在碱性环境下制取CaO2,常用冰水浴控制温度在0℃左右,其可能的原因分析为:温度低可减少过氧化氢的分解,提高过氧化氢的利用率,该反应是放热反应,温度低有利于提高CaO2·8H2O产率,答案为:温度低可减少过氧化氢的分解,提高过氧化氢的利用率;
(3)过氧化钙氧化碘化钾生成碘单质,碘遇淀粉变蓝,故指示剂选淀粉溶液;根据电子转移守恒关系及题中反应方程式,可得关系式:CaO2~I2~2S2O32- ,设样品中CaO2的质量分数为x,则

则72g:agx=2mol:0.001cVmol,解得x=![]() %,答案为:淀粉溶液;
%,答案为:淀粉溶液;![]() %。
%。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】298K、25℃,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述不正确的是

已知:298K(25℃)H2S的Ka1=9.10×10-8,Ka2=1.10×10-12。
A.0.10mol/LNaHS溶液:c(Na+)>c(HS)>c(S2)>c(OH)>c(H+)
B.Na2S溶液中:c(Na+)=2c(S2)+2c(HS)+2c(H2S)
C.随着c(NaHS)浓度的增大c(H+)也将持续增大
D.当c(OH)=c(S2)时,c(H+)=10-9mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是( )
A. 实验室制取氨气
实验室制取氨气
B. 证明乙炔可使溴水褪色
证明乙炔可使溴水褪色
C. 检验蔗糖的水解产物具有还原性
检验蔗糖的水解产物具有还原性
D. 证明溶解度:AgCl>AgI
证明溶解度:AgCl>AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成![]() 。
。
回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式
_________________________________________________________________。
(2)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水
③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(3)写出可溶性铝盐与氨水反应的离子方程式
_________________________________________________________________。
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种常见金属组成的混合物A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
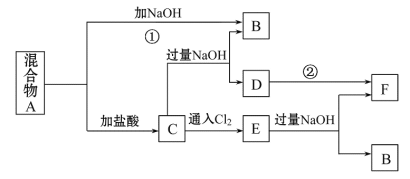
回答下列问题:
(1)混合物A的成分是_________(请填化学式)。
(2)反应①的离子方程式为:__________。
(3)反应②的化学方程式为:__________。
(4)写出E中加入过量NaOH的所有反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种透明、不溶于水的坚硬固体。A固体在氧气中完全燃烧只得到一种无色无味气体,此气体能使澄清石灰水变浑浊,标准状况下测得此气体的密度是氧气密度的1.375倍。B固体能溶于热的苛性钠溶液,再往该溶液中加入过量盐酸时,析出白色沉淀,此沉淀是一种比H2CO3还弱的酸,干燥后为不溶于水的白色粉末。B与石灰石、纯碱按一定比例混合加热后,能得到C,C在高温时软化,无固定熔点。根据以上事实,判断A、B、C各为何物:_______、_______、_______;写出有关反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷烯(如图)是由磷原子六元环组成的蜂巢状褶皱二维晶体,它是白磷(![]() )的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是
)的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是
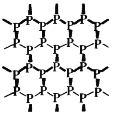
A.3.1g白磷中含P—P键的数目为0.3NA
B.6.2g磷烯中含六元环的数目为0.1NA
C.0.1molP4与0.6molH2在密闭容器中发生反应P4+6H2![]() 4PH3,生成PH3分子的数目为0.4NA
4PH3,生成PH3分子的数目为0.4NA
D.0.1molP4发生反应P4+5O2=2P2O5,转移的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1
②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大
③具有相似的化学性质,都是活泼金属
④都具有强还原性,在化合物中显![]() 价
价
⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④B.①③⑤C.②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、用![]() 表示原子,N表示中子数。
表示原子,N表示中子数。
⑴阳离子的中子数:![]() 共有x个电子,则
共有x个电子,则![]() _______。
_______。
⑵阴离子的中子数:![]() 共有x个电子,则
共有x个电子,则![]() ________。
________。
⑶A2-原子核内有x个中子,其质量数为m,则ng A2-所含电子的物质的量为______mol。
Ⅱ、下列变化:
①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氯气溶于水⑥氯化铵受热分解。
⑷未发生化学键破坏的是________;![]() 填序号,下同
填序号,下同![]() 仅发生离子键破坏的是__________。
仅发生离子键破坏的是__________。
⑸若上述物质都为纯净物时,属于共价化合物的是_____;属于离子化合物的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com