
【题目】下表中相关物质的信息都正确的一项是
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
B | H2O2 |
| 不稳定,易分解 | 医用消毒剂 |
C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生反应X(g)+2Y(g)![]() 3Z(g) ΔH=-a kJ·molˉ1 (a>0),下列说法正确的是 ( )
3Z(g) ΔH=-a kJ·molˉ1 (a>0),下列说法正确的是 ( )
A.容器内气体的压强不再发生变化,说明反应达到平衡状态
B.达到化学平衡状态时,反应放出的总热量可能为 a kJ
C.当反应进行了2min时X的浓度减少了0.1mol/L ,则Z的反应速率为0.15mol·L-1·s-1
D.降低反应温度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴加少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色胶状沉淀生成;(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是( )

A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=10
D. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子结构及性质如表所示
元素 | 结构及性质 |
A | A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | D与B同主族,且通常状况下D没有正化合价 |
E | E在周期表中位于IA族,有人认为将其排在VIIA族也有一定道理 |
F | F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)C元素在周期表中的位置_____________;E形成的一种简单离子能支持“将E排在VIIA族”这一观点,该离子的结构示意图为_______________________。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为________________________________。
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式__________________________(用相应化学式表示)
(3)请画出化合物F2B2的电子式__________,该化合物中含有的化学键类型是_______。
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向_________(填“A”或“C”),写出该原电池总反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业生产过程中,涉及SO2转化为SO3的反应,某化学研究小组在450 ℃时,在一容积为10 L 的恒容密闭容器中研究该可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),得出的相关数据如表所示:
2SO3(g),得出的相关数据如表所示:
时间/min | n(SO2)/mol | n(O2)/mol | n(SO3)/mol |
0 | 0.200 | 0.100 | 0 |
10 | 0.190 | 0.095 | 0.010 |
15 | 0.160 | 0.080 | 0.040 |
20 | 0.160 | 0.080 | 0.040 |
25 | 0.150 | 0.150 | 0.050 |
根据表中数据,下列判断正确的是
A. 0~10 min内的反应速率可表示为v(SO2)=0.010 mol/(L·min)
B. 15~20 min内,正、逆反应速率不相等
C. 工业上常用增加SO2的量来提高O2的转化率
D. 20~25 min内,数据变化的原因可能是增加了O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.长石(KAlSi3O8)用氧化物形式可表示为K2O·Al2O3·3SiO2
B.溶于水电离出H+的化合物都是酸
C.难溶于水的氢氧化物其对应的氧化物也难溶于水
D.铁合金的熔点、硬度都高于纯铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是

A. 图中五点Kw间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量酸的方法
C. 若从A点到C点,在温度不变时向水中加入适量NH4Cl固体
D. 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)环境污染已成人类社会面临的重大威胁。下列名词与环境污染无关的是________(填:序号)。
①赤潮 ②温室效应 ③酸雨 ④光化学烟雾 ⑤水力发电 ⑥臭氧层空洞 ⑦潮汐 ⑧农药化肥的不当使用 ⑨地方性大脖子病 ⑩工业“三废”和生活污水的任意排放
(2)火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(NO2),已知热化学方程式:
N2(g)+2O2(g)==2NO2(g) △H=+67.7kJ/mol; N2H4(g)+O2(g)==N2(g)+2H2O(g) △H=-534kJ/mol。请写出气态肼与NO2气体反应生成氮气和水蒸气的热化学方程式___________________________。该反应应用于火箭推进,除能释放大量热和快速产生大量气体外,还有一个很突出的优点是:________________________________________________。
(3)乙烯(C2H4)结构简式为CH2=CH2,且知:C-H键、C=C键、O=O键、C=O键、O-H键的键能分别是:413kJ/mol、615kJ/mol、496kJ/mol、745kJ/mol、463kJ/mol,则表达乙烯(C2H4)气体“燃烧热”的热化学方程式:C2H4(g) +3O2(g) =2CO2(g) +2H2O(l)中,△H=-______kJ/mol。
如果有2.4NA个电子发生转移,所放出的热量值是____________kJ。
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成N3-。两步反应的能量变化如图:
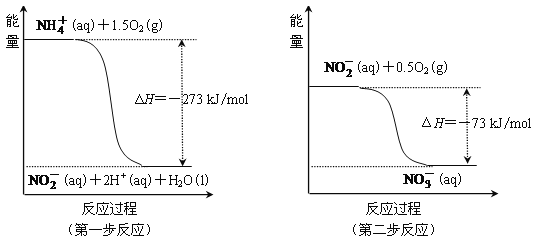
①第一步是______反应(选填“放热”或“吸热”),判断依据是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com