
【题目】根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H2= -28.5kJ/mol
2Fe(s)+3CO2(g) H2= -28.5kJ/mol
③C(石墨)+ CO2(g) = 2CO(g) H3= akJ/mol ,
则a=__________kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为_______。
②下列情况标志反应达到平衡状态的是________(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
【答案】 K= c(CO2)3 /c(CO)3 减小 +172.5 60% a
【解析】(1)根据平衡常数的概念,由于固体物质或纯液体的浓度是常数,不能写入表达式,则高炉炼铁的平衡常数K=c3(CO2)/c3(CO);升高温度,平衡向吸热的方向移动,结合方程式:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,即平衡向左移动,故平衡常数减小;(2)根据盖斯定律:(①-②)÷3=(△H1-△H2)÷3= +172.5 kJ/mol;(3)①起始时甲容器中c3(CO2)/c3(CO)=1.03/1.03=1<64,说明该反应一定从正反应方向开始进行,反应物浓度减小,生成物浓度增大,直到达到新的平衡,设CO的平衡转化率为x,则:
2Fe(s)+3CO2(g) H=-28.5kJ/mol,即平衡向左移动,故平衡常数减小;(2)根据盖斯定律:(①-②)÷3=(△H1-△H2)÷3= +172.5 kJ/mol;(3)①起始时甲容器中c3(CO2)/c3(CO)=1.03/1.03=1<64,说明该反应一定从正反应方向开始进行,反应物浓度减小,生成物浓度增大,直到达到新的平衡,设CO的平衡转化率为x,则:
Fe2O3(s) + 3CO(g) ![]() 2Fe(s) + 3CO2(g)
2Fe(s) + 3CO2(g)
起始浓度/ mol·L-1 0.5 0.5
变化浓度/ mol·L-1 0.5x 0.5x
平衡浓度/ mol·L-1 0.5-0.5x 0.5+0.5x
K=c3(CO2)/c3(CO)="(" 0.5+0.5x)3/(0.5-0.5x)3=64
( 1+x)3/(1-x)3=64,则( 1+x)/(1-x)=4,1+x=4-4x,5x=3,x=0.6或60%
②混合气体的密度=混合气体的总质量/容器的容积,由于反应物和生成物中都有固体物质参加,且平衡前混合气体的总质量会增大,只有平衡时混合气体的总质量才保持不变,密度才不变,a正确;正反应是气态物质体积保持不变的反应,则反应前后气态物质的物质的量保持不变,则平衡前后气体的压强不变,b错误;CO的消耗速率和CO2的生成速率均为正反应速率,c错误。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其它相关物质可能省略)下列说法不正确的是( )
![]()
A. 若A为非金属单质,则D一定为硝酸或硫酸
B. 若A为金属单质,则组成A的元素一定位于第三周期第IA族
C. 不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下能使铁和铝发生钝化
D. 若A是共价化含物,A的水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图示细胞中各种化合物或主要元素占细胞鲜重的含量,以下按①②③④顺序排列,正确的是

A. 水、蛋白质、糖类、脂质;N、H、0、C
B. 蛋白质、糖类、脂质、水;0、C. N、H
C. 水、蛋白质、脂质、糖类;H、0、C.N
D. 蛋白质、水、脂质、糖类;C.0、H、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸(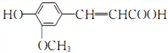 )能清除人体内的自由基,调节人体生理机能,某实验小组设计如下合成阿魏酸的路线(部分反应条件已略去):
)能清除人体内的自由基,调节人体生理机能,某实验小组设计如下合成阿魏酸的路线(部分反应条件已略去):

已知:①A能使氯化铁溶液显紫色,核磁共振氢谱有4组峰。
②两个羟基连在同一个碳原子上不稳定,易脱水形成羟基。
回答下列问题:
(1)A的名称为____________。
(2)由D生成E的反应类型为___________,由F生成G的反应类型为__________。
(3)写出B和NaOH溶液反应的化学方程式:________________________________。
(4)下列有关阿魏酸的说法中不正确的是_________。
a.阿魏酸分子中最多有10个碳原子共平面
b.阿魏酸能与乙醇在一定条件下发生取代反应
c.阿魏酸可清除体内有氧化性的自由基
d.阿魏酸能与酸性高锰酸钾溶液反应的官能团只有一种
(5)F的结构简式为_________。
(6)C的芳香族同分异构体有多种,写出两种能与NaOH溶液反应的同分异构体的结构简式:________________________________。
(7)利用![]() 制备
制备![]() ,请写出合成路线(其他无机试剂可任选)_________________________________________________________________________________。
,请写出合成路线(其他无机试剂可任选)_________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示是由3个圆所构成的类别关系图,其中I为大圆,II和III分别为大圆之内的小圆。下列选项中符合这种类别关系的是( )

A. I: DNA II: RNA III:核酸
B. I:还原性糖 II:果糖 III:蔗糖
C. I:固醇 II:胆固醇 III:维生素D
D. I:蛋白质 II:酶 III:激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H2A在水中的电离方程式是H2A = H+ + HA﹣,HA﹣![]() H+ + A2﹣.回答下列问题:
H+ + A2﹣.回答下列问题:
(1)Na2A溶液显______________(填“酸性”、“中性”或“碱性”),理由是________________________________(用离子方程式或必要的文字说明).
(2)常温下,已知0.1molL﹣1NaHA溶液pH=2,则0.1molL﹣1H2A溶液中氢离子的物质的量浓度可能______0.11molL﹣1(填“大于”、“等于”或“小于”),理由是_____________________.
(3)0.1molL﹣1NaHA溶液中各种离子浓度由大到小的顺序是_________.
(4)Na2A溶液中,下列表述正确的是_________.
A.c(Na+) + c(H+)= c(HA﹣)+ 2c(A2﹣)+ c(OH﹣)
B. c(OH﹣)= c(HA﹣)+ c(H+)
C.c(OH﹣)= c(HA﹣)+ c(H+)+ 2c(H2A)
D.c (Na+)= 2[c(HA﹣)+ c(A2﹣) + c(H2A)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氧化还原反应KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O中,当生成0.5 mol Cl2时,氧化产物和还原产物的物质的量之比为( )
A.5:1B.3:1C.1:3D.1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Br2+2Fe2+===2Fe3++2Br-。向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度(mol·L-1)为( )
A. 2 B. 4 C. 2.5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)

(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)______________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________。
(4)判断BaCl2已过量的方法是____________________________________。
(5)下列是某学生设计操作A后混合液中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验_____离子,应先加入过量的_____________________。
②将所得混合物______(填操作名称),然后在溶液中加入试剂________检验另一离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com