
| A. | 通入少量 HCl 气体 | B. | 加入少量 NaOH 固体 | ||
| C. | 加入少量 H2O | D. | 适当升高温度 |
分析 A.HCl溶于水后的盐酸是强酸,与①NH3•H2O 反应,c(NH4+)增大;盐酸中的氢离子抑制了铵离子的水解,c(NH4+)也增大;
B.氢氧化钠属于强碱,加入少量NaOH固体,溶液中的c(OH-)增大,抑制了氨水的电离;氢氧根离子结合铵离子生成一水合氨,铵离子浓度减小;
C.加入少量H2O,溶液被稀释,两种溶液中c(NH4+)都会减小;
D.升高温度,②氨气会从溶液中挥发出来,导致NH3•H2O 浓度减小,c(NH4+)自然减小;②NH4Cl溶液,升高温度后,促进了水解,c(NH4+)减小.
解答 解:A.HCl溶于水后得到的盐酸是强酸,能够和①NH3•H2O 反应,导致溶液中c(NH4+)增大;盐酸中的H+离子抑制了NH4+的水解,使氯化铵溶液中的c(NH4+)也增大,故A正确;
B.加入少量NaOH固体,溶液中的c(OH-)增大,抑制了NH3•H2O 溶液的电离;氢氧根离子结合NH4+生成一水合氨,c(NH4+)都会减小,所以两溶液中铵离子浓度都减小,故B错误;
C.当向①0.01mol L-1NH3•H2O ②0.01mol L-1NH4Cl加入少量H2O后,溶液被稀释了,两溶液中的c(NH4+)都会减小,故C错误;
D.温度升高,氨气具有挥发性,导致氨气挥发,NH3•H2O 浓度减小,溶液中的c(NH4+)减小;而NH4Cl溶液中,铵根离子的水解为吸热反应,升高温度可以促进NH4+水解,导致c(NH4+)减小,故D错误;
故选A.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,明确电离平衡及其影响为解答关键,注意掌握盐的水解原理,试题侧重考查学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | “低碳”意指更低的二氧化碳气体的排放 | |
| B. | 太阳能、水能、风能都属于可再生能源 | |
| C. | 太阳能电池的工作原理是光能与化学能的转换 | |
| D. | 利用燃气轮机进行天然气发电不属于可再生能源利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 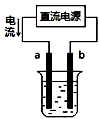 用装置精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 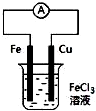 装置的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 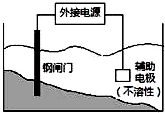 装置中钢闸门应与外接电源的负极相连 | |
| D. | 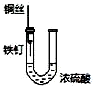 装置中的发生的是铁钉的析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个分子中都含有氮分子 | B. | 每个分子中的氮原子个数相等 | ||
| C. | 每种物质中氮元素的质量分数相同 | D. | 都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| B. | pH=12的溶液中 NO3-、I-、Na+ | |
| C. | NaHS溶液中 SO42-、K+、Cl-、Al3+ | |
| D. | 使甲基橙变红的溶液中 C6H5O-、K+、SO42-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com