
【题目】下列化学方程式或离子方程式书写错误的是
A. 从海带中提取碘:H2O2 + 2I—+ 2H+ = 2H2O + I2
B. 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
C. 苯与溴的反应:
D. 金属锂在空气中加热:2Li+O2 ![]() Li2O2
Li2O2
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:
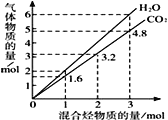
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )
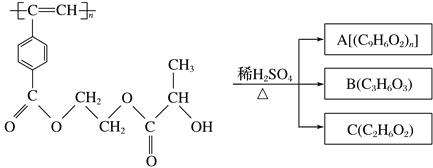
M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾成因有多种,其中燃煤过程中产生的二氧化硫、氮氧化物以及可吸入颗粒物是山西冬季雾霾的主要组成。治霾迫在眉睫,利在千秋。
I.脱氮
已知: ①2CO(g)+O2(g)===2CO2(g) ΔH1=-566.0 kJ·mol-1
②2NO(g)+O2===2NO2(g) ΔH2=-116.5kJ·mol-1
③N2(g)+O2(g)===2NO(g) ΔH3=+180.5kJ·mol-1
(1)则燃煤所产生的废气中NO2 与CO 转化成无污染气体的热化学方程式为:________________________________。
(2)若1molN2(g)1mo1O2(g)分子中化学键断裂时分别吸收946kJ、498KJ的能量,则1mo1NO(g) 分子中化学键断裂时需要吸收的能量为_____________________KJ。
Ⅱ.脱硫的反应原理2CO(g) +SO2(g)![]() 2CO2(g) +S(1) ΔH=-QkJ·mol-1(Q>0)
2CO2(g) +S(1) ΔH=-QkJ·mol-1(Q>0)
(1)若在一定温度下,将总物质的量为3 mol的CO(g)和SO2(g) 以不同比例充入2 L的恒容容器中,结果如图所示。a、b分别表示SO2、CO的平衡转化率的变化,c表示平衡体系中CO2的体积分数的变化。
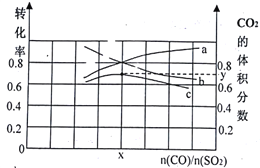
由图计算x=__________;CO2的体积分数y=_________(精确到0.01),该温度下的平衡常数K=_____。
(2)在T1℃下,将CO与SO2按体积比为5∶4充入一恒压密闭容器中,此时容器体积为0.1V L。
①下列能判断该反应达到化学平衡状态的是_____________。
a.S(l)的质量不变
b.K不变
c.容器中气体的平均相对分子质量不变
d.2v正(SO2)= v正(CO2)
e.Q值不变
②压强一定的条件下,在不同温度下进行反应,测得容器的体积变化如图所示:
已知: n1≠n2
温度(℃) | 初始投入总量 | 初始投料v (CO) /v (SO2) | 初始体积(L) | 平衡体积(L) |
T1 | n1 | 5∶4 | 0.1v | 0.07v |
T2 | n2 | 5∶4 | 0.3v | 0.22v |
求:T1温度时,SO2的平衡转化率为_____%;
比较大小,T1___T2(填“>”、“<”、“=”),解释原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验中,不能达到相应实验目的的是
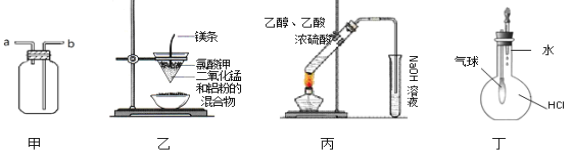
A.装置甲:气体从b口进入,收集Cl2
B.装置乙:可制得金属锰
C.装置丙:实验室制取乙酸乙酯
D.装置丁:验证HCl气体在水中的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.将浓硫酸转移至容量瓶中,加水稀释至距标线2~3 cm处,改用胶头滴管定容
B.用酒精萃取碘水中的碘单质
C.进行液体蒸馏实验时,冷凝管中应充满自来水
D.某溶液加入盐酸酸化的氯化钡溶液后,出现白色沉淀,则原溶液中必有SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA)是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期在医学上使用,作手术缝合线及骨钉等,现在则已较广泛应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出的淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米秸秆、麦秆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为___________________________________________。
(2)已知1 mol葡萄糖![]() 2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8 g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
②另取1.8 g乳酸与过量的金属钠反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
由实验数据推知乳酸分子含有________(填官能团名称),从以上条件推知乳酸的结构简式可能为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷尾矿难溶于水,主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了用磷尾矿制备CaCO3、Mg(OH)2、P4和CO的方案,其工艺流程图如下:
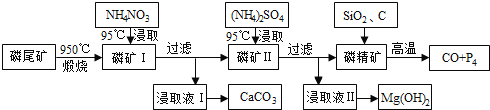
请回答下列问题:
(1)磷精矿[Ca5(PO4)3F]分解温度_______________(填“高于”、“低于” )950℃;
(2)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是________________,第一次浸取液用NH4NO3而不用的(NH4)2SO4原因是__________________________。
(3)磷精矿与SiO2、C发生反应时被还原的物质是_______________。
(4)其产物CO在工业上有重要的综合应用,现以CO、H2O、熔融Na2O组成的电池装置如图所示。
写出石墨Ⅰ电极上发生反应的电极反应式_______________,Na+向________(填写“石墨Ⅰ”或“石墨Ⅱ”)移动。
(5)CO也可由甲酸(HCOOH)制取,甲酸是易溶于水的一元弱酸。
①常温下关于1 L 0.1 mol·L-1 HCOONa溶液,下列关系不正确的是____________。
a.c(H+)·c(OH-)=1×10-14
b.c(H+)+c(HCOOH)=c(OH-)
c.c(Na+)=c(HCOOH)+c(HCOO-)
d.c(Na+)>c(H+)>c(HCOO-)>c(OH-)
②向1 L 0.1 mol·L-1 HCOONa溶液中加水稀释后,c(HCOOH)·c(OH-)的数值________(填写“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com