
| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| ||


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、7.89过氧化钠中含有的离子数为0.4NA |
| B、将0.1molFeCl3水解制成胶体,所得胶体粒子数为0.1NA |
| C、等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等 |
| D、常温常压下28 g CO与22.4 L O2所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
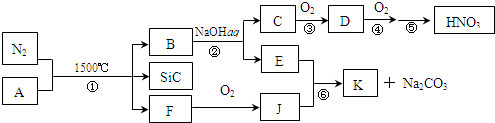
 物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):请回答:
物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL |
| B、190mL |
| C、150mL或190mL |
| D、180mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,NA个水分子所占有的体积约为22.4L |
| B、5.6g铁与氯气完全反应,失去电子数目为0.2NA |
| C、1molCl2发生化学反应,转移的电子数可能为NA |
| D、氢气的摩尔质量等与NA个氢气分子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||||||
B、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3
| ||||||
C、向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2C
| ||||||
| D、甘氨酸(H2N-CH2-COOH)与氢氧化钠溶液反应:H2N-CH2-COOH+OH-→H2N-CH2COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com