
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确是
A.加入KSCN溶液一定不变红色
B.溶液中一定含Cu2+
C.溶液中一定含Fe2+
D.剩余固体中一定含铜
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届山东省济宁市高三10月阶段测试化学试卷(解析版) 题型:选择题
阿伏加德罗常数约为6.02×1023 mol—1,下列叙述中正确的是( )
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.标准状况下,a L乙烷气体中的所含化学键数约为(a/22.4)×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:填空题
(10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2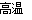 6SO2+Fe3O4,有3 mol FeS2参加反应,转移________mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移________mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为_____________;从腐蚀废液回收得到金属铜,还需要的试剂是________。
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是______________________________________ 。
(4)钢铁的电化腐蚀原理如图所示,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在图中虚线框内作出修改,并用箭头标出电子流动方向。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
分类是化学学习与研究的常用方法,下列分类正确的是 ( )
A.Na2O、CaO、Al2O3均属于碱性氧化物
B.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.烧碱、纯碱均属于碱
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:填空题
溶液配制是中学化学实验的基本操作。
(1)用氢氧化钠固体配制100 mL 1.0mol·L-1氢氧化钠溶液时,需要用到的玻璃仪器有玻璃棒、胶头滴管、烧杯、量筒和 ________________________________。
(2)配制一定物质的量浓度溶液时用到的仪器较多,下列有关叙述正确的是_____。
a.称量NaOH固体时,分别在天平的两个托盘垫上相同大小的纸片
b.玻璃棒的作用是搅拌、引流
c.用浓硫酸配制稀溶液时,在量筒中稀释后要冷却至室温再转移到容量瓶中
d.容量瓶在使用前要检查是否漏水
(3)实验室配制一定物质的量浓度硫酸溶液,在用量筒量取浓硫酸时俯视读数,结果配制出的硫酸溶液浓度将会________。(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
下表中关于物质分类的正确组合是
类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | CuO | H2SO4 | NH3·H2O | Na2S |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
D | NO2 | CaO | HNO3 | Cu2(OH)2CO3 | CaCO3 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(12分)甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。
(1)已知在常温常压下:
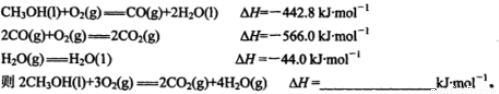
(2)工业上正在研究利用CO2和H2来生产甲醇燃料的方法,该反应为:
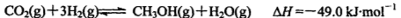
在某温度下,将6mol CO2和8mol H2 充入容积为2L的密闭容器中,8分钟时达平衡状态,H2的转化率为75%。请回答:
①用CH3OH表示该反应在0-8min内的平均反应速率v(CH3OH) = .
②此温度下该反应平衡常数K=____________;
③若在上述平衡体系中,再充入2mol H2,反应达到平衡后H2的转化率_________75% (填“大于”、“小于”或“等于”)。
(3) 一氧化碳与氢气也可以合成甲醇: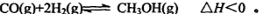
①若该反应在恒温恒容条件下进行,下列说法正确的是 ;
a.若混合气体的密度不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入CH3OH(g)使压强增大,平衡向右移动
c.反应达到平衡后,通入氩气使压强增大,平衡向右移动
d.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
e.若使用催化剂,会改变反应的途径,但反应的焓变不变
②某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数
K=50 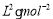 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:

请比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g) = N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH<0
C.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:选择题
下列离子方程式的书写正确的是
A.氢氧化钡和稀硫酸反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
B.铜片跟稀硝酸反应:Cu+NO3-+4H+===Cu2++NO↑+2H2O
C.醋酸除去水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
D.硫酸亚铁溶液与过氧化氢溶液混合:2Fe2++H2O2+2H+===2Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com