
【题目】某化工厂用石墨电解Na2CrO4溶液制备Na2Cr2O7的模拟装置如下图所示,下列有关说法错误的

A. 溶液中OH-由阴极区流向阳极区
B. 阳极的电极反应式为2H2O-4e-=O2↑+4H+
C. 阳极区产生的气体与阴极区产生的气体在相同状况下体积之比为1∶2
D. Na2CrO4转化为Na2Cr2O7的离子方程式为2CrO42-+2H+=Cr2O72-+H2O
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有下列七种物质的溶液:
①NaCl ②NH4Cl ③Na2CO3 ④CH3COONa ⑤CH3COOH ⑥NaHCO3
(1)溶液呈酸性的有_____________,呈碱性的有____________,呈中性的有_____________。
(2)写出②④水解的离子方程式:________________________、______________________
(3)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类_____________(填相同或是不相同),溶液的PH:③_________⑥(填 >、=或 <)。
(4)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是______________。
A.c(H+) B. C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
(1)A中制取C12反应的化学方程式是_____________________________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(3)E装置的作用是______________(填序号)。
A.收集气体B.吸收氯气C.吸收氯化氢
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(5)将lmolCH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示,下列有关说法正确的是
x | y | w | |
n(起始)/mol | 2 | l | 0 |
n(平衡)/mol | l | 0.5 | 1.5 |
A. 该温度下,此反应的平衡常数表达式是![]()
B. 升高温度,若w的体积分数减小,则此反应ΔH>0
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中加入足量活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
请回答下列问题:
(1) 0—5 min内,以CO2表示的该反应速率v(CO2)=____,该条件下的平衡常数K=____。
(2) 第15 min后,温度调整到T2,数据变化如上表所示,则T1___T2(填“>”、“<”或“=” )。
(3)若30 min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则该可逆反应最终达平衡时NO的转化率α=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是
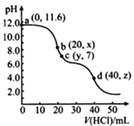
A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6
B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
C. a、c两点水的c(OH-)之比为10-11.6 :10-7
D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了下列关于氯化铵的课外实验:
(实验操作)

浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(1)氯化铵饱和溶液中离子浓度由大到小的顺序是________。白烟的成分是______________。
(2)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因(写出一条即可)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列盐溶液水解的离子方程式
(1)次氯酸钾(KClO)溶液__________________________________________________;
(2)磷酸钠(Na3PO4)溶液___________________________________________________;
(3)明矾净水水解原理____________________________________________;
(4)硫酸铁溶液__________________________________________
(5)泡沫灭火器的原理__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com