
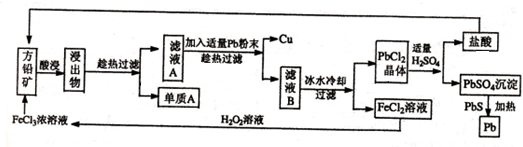
���� ��Ǧ���м����Ȼ�����Һ���������������ԭ��Ӧ����S������ҺA����FeCl2��CuCl2�Լ�PbCl2�ȣ���������Pb�ۿ��û���ͭ����ҺB�к���FeCl2��PbCl2�ȣ�����ˮ��ȴ�����˿ɵõ�PbCl2���壬��������������������������Ǧ�����������ѭ��ʹ�ã�����Ǧ�м���PbS����������ԭ��Ӧ����Pb�Ͷ����������壬FeCl2��Һ�м���������⣬����������ԭ��Ӧ����FeCl3����ѭ��ʹ�ã��Դ˽����⣮
��� �⣺��Ǧ���м����Ȼ�����Һ���������������ԭ��Ӧ����S������ҺA����FeCl2��CuCl2�Լ�PbCl2�ȣ���������Pb�ۿ��û���ͭ����ҺB�к���FeCl2��PbCl2�ȣ�����ˮ��ȴ�����˿ɵõ�PbCl2���壬��������������������������Ǧ�����������ѭ��ʹ�ã�����Ǧ�м���PbS����������ԭ��Ӧ����Pb�Ͷ����������壬FeCl2��Һ�м���������⣬����������ԭ��Ӧ����FeCl3����ѭ��ʹ�ã�
��1��CuFeS2��CuΪ+2�ۣ�SΪ-2�ۣ���FeԪ�صĻ��ϼ�Ϊ+2�ۣ���Ǧ�����Ϊ�������Һ�ķ�Ӧ��Ϊ��߷�Ӧ�����ʣ��ɼ��ȡ�������ҺŨ�ȡ��������ĽӴ���������ȣ��ʴ�Ϊ��+2�����裬�ʵ�������Ũ�ȣ����ȣ�����ʯ���飬�ӳ���ȡʱ��ȣ�
��2�����˹������õ��IJ����������ձ�����������©���������Ϸ�����֪����A��S���ڴ˹��ղ����п�ѭ�����õ�������Ǧ�����ᡢ�Ȼ�����Һ��
�ʴ�Ϊ��©����S��������Ȼ�����Һ��
��3��FeCl2��Һ�м���������⣬����������ԭ��Ӧ����FeCl3����Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O���ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
��4������Ǧ�м���PbS����������ԭ��Ӧ����Pb�Ͷ����������壬��Ӧ�Ļ�ѧ����ʽΪPbSO4+PbS$\frac{\underline{\;\;��\;\;}}{\;}$2Pb+2SO2����PbSO4ת��ΪPbCO3��Ӧ��ƽ�ⳣ������ʽK=$\frac{c��B{a}^{2+}����c��S{{O}_{4}}^{2-}��}{c��B{a}^{2+}����c��C{{O}_{3}}^{2-}��}$=$\frac{c��S{{O}_{4}}^{2-}��}{c��C{{O}_{3}}^{2-}��}$��
�ʴ�Ϊ��PbSO4+PbS$\frac{\underline{\;\;��\;\;}}{\;}$2Pb+2SO2����$\frac{c��S{{O}_{4}}^{2-}��}{c��C{{O}_{3}}^{2-}��}$��
��5�����ʱ��������PbSO4ʧ���ӷ���������Ӧ���缫��ӦʽΪPbSO4-2e-+2H2O=PbO2+SO42-+4H+���ʴ�Ϊ��PbSO4-2e-+2H2O=PbO2+SO42-+4H+��
���� ���⿼������ķ�����ᴿ��ԭ��ؼ�����ԭ����Ϊ�߿���Ƶ�㣬���ؿ���ѧ���������ƶϡ�֪ʶ������������ȷ����ͼ�и������跢���ķ�Ӧ���������������ڵ����ʵ�֪ʶ�㼴�ɽ����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
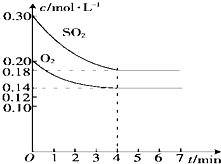 ���ݻ�Ϊ10L���ܱ�������ͨ��һ������SO2��O2��450��ʱ������Ӧ��2SO2+O2?2SO3������Ӧ���ȣ���SO2��O2�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ��ʾ����ش��������⣺
���ݻ�Ϊ10L���ܱ�������ͨ��һ������SO2��O2��450��ʱ������Ӧ��2SO2+O2?2SO3������Ӧ���ȣ���SO2��O2�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ��ʾ����ش��������⣺| �ı������ | v�� | v�� |
| �ټ�СSO2��Ũ�� | ��С | ���� |
| �ڼ�СSO3��Ũ�� | ���� | ��С |
| ������������� | ���� | ���� |
| �ܼ���V2O5������ | ���� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ԫ����ǽ���Ԫ�����γɹ��ۻ����� | |
| B�� | ֻ����ԭ���У�������������������� | |
| C�� | Ŀǰʹ�õ�Ԫ�����ڱ��У�������ں���36��Ԫ�� | |
| D�� | ���ͳ�����Ϊͬλ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
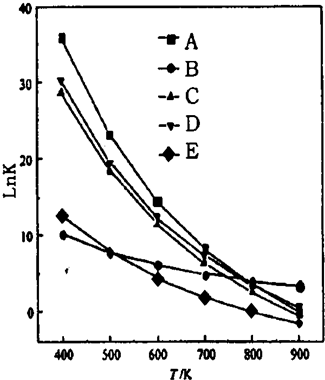 CO��g��+H2O��g��=CO2��g��+H2��g����H=-41kJ/mol�¶����ߣ�ƽ�����淽���ƶ�����һ��������������������CO��ʹCOת���ʸ��ͣ�
CO��g��+H2O��g��=CO2��g��+H2��g����H=-41kJ/mol�¶����ߣ�ƽ�����淽���ƶ�����һ��������������������CO��ʹCOת���ʸ��ͣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �Ҵ� | ������ | ������ | 1-�嶡�� | |
| �ܶ�/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| �е�/�� | 78.5 | 38.4 | 117.2 | 101.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A�� | 4 sʱ������c��Y��=0.76 mol/L | |
| B�� | 830���ƽ��ʱ��X��ת����Ϊ80% | |
| C�� | ��Ӧ��ƽ��������¶ȣ�ƽ�������ƶ� | |
| D�� | 1200��ʱ��ӦR��g��+Q��g��?X��g��+Y��g����ƽ�ⳣ��K=0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

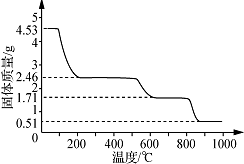
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��A��Ԫ���γɵĵ��ʵ��۵���Ԫ��ԭ��������������� | |
| B�� | ��A��Ԫ�����γ�-1������ | |
| C�� | ����������ˮ���������� | |
| D�� | ���ϵ�����̬�⻯����ȶ���������ǿ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com