
已知 4NH3(气)+5O2(气)=4NO(气)+6H2O(气),若反应速率分别是V(NH3)、V(O2)、V(NO)、V(H2O)[mol/L•min]表示,则正确的关系是()
A. 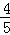 V(NH3)=V(O2) B.
V(NH3)=V(O2) B. 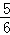 V(O2)=V(H2O) C.
V(O2)=V(H2O) C. 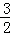 V(NH3)=V(H2O) D.
V(NH3)=V(H2O) D. 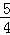 V(O2)=V(NO)
V(O2)=V(NO)
考点: 反应速率的定量表示方法.
专题: 化学反应速率专题.
分析: 同一化学反应、同一时间段内,各物质的反应速率之比等于计量数之比,据此分析解答.
解答: 解:同一化学反应、同一时间段内,各物质的反应速率之比等于计量数之比.
A、V(NH3):V(O2)=4:5,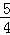 V(NH3)=V(O2),故A错误.
V(NH3)=V(O2),故A错误.
B、V(O2):V(H2O)=5:6,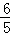 V(O2)=V(H2O),故B错误.
V(O2)=V(H2O),故B错误.
C、V(NH3):V(H2O)=4:6=2:3,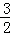 V(NH3)=V(H2O),故C正确.
V(NH3)=V(H2O),故C正确.
D、V(O2):V(NO)=5:4,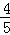 V(O2)=V(NO),故D错误.
V(O2)=V(NO),故D错误.
故选C.
点评: 本题考查了化学反应速率的定量表示方法,根据“同一化学反应、同一时间段内,各物质的反应速率之比等于计量数之比”解答即可.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
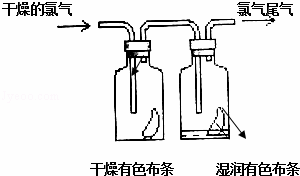
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是 .
(2)为防止氯气尾气污染空气,实验室通常用NaOH溶液吸收多余的氯气,原理是(用离子方程式表示) .
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是 (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是 (用字母代号填).
A.O2B.Cl2C.CO2D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散.当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是 (用字母代号填).
A.NaOH B.NaCl C.KCl D.Na2CO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
现有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中,YX3在常温下呈气态,能使酚酞溶液变红色.下列有关推断正确的是( )
A. 简单离子半径:Y>Z>W>Q>X
B. W2Z2与X2Z反应中氧化剂与还原剂物质的量之比为1:2
C. X能分别与Y、Z、W形成共价化合物
D. Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
可确认发生了化学平衡移动的是()
A. 化学反应速率发生了改变
B. 有气态物质参加的可逆反应达到平衡后,改变了压强
C. 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D. 可逆反应达到平衡后,使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3mol气态高能燃料乙硼烷B2H6在O2中燃烧,生成固态B2O3和液态H2O,放出649.5kJ的热量.下列热化学方程式正确的是()
A. B2H6(g)+302(g)═B2O3(s)+3H2O(l)△H=2165 kJ•mol﹣1
B. B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=﹣2165 kJ•mol﹣1
C. B2H6+3O2═B2O3+3H2O△H=﹣2165 kJ•mol﹣1
D. B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=﹣2165 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)⇌nZ(g)+2W(g).5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/L•min,则n的值为()
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下用NH3捕获CO2可以生成重要的有机化工产品﹣﹣三聚氰酸,反应的化学方程式如下:NH3+CO2→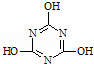 +H2O下列有关三聚氰酸的说法正确的是()
+H2O下列有关三聚氰酸的说法正确的是()
A. 分子式为C3H6N3O3
B. 分子中既含极性键,又含非极性键
C. 属于共价化合物
D. 生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2、CH3COOH是生活中常见的物质,在化学研究中应用广泛.
(1)某小组拟在Fe3+的催化下,探究H2O2分解速率影响的某一因素.限选试剂与仪器:30% H2O2、0.1mol∙L﹣1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
将表中所给的混合溶液分别加入到2个同容积的锥形瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 锥形瓶编号 | 30% H2O2/mL | 0.1mol∙L﹣1Fe2(SO4)3/mL | 蒸馏水/mL | 反应温度/℃ |
| 1 | 10 | 1 | 0 | 30 |
| 2 | Vx | 1 | 5 | 30 |
表中Vx= mL,实验目的是 .
(2)醋酸和盐酸是化学实验中常见的二种一元酸,某小组设计下列实验证明它们的电离程度.
实验一:室温下,测出0.1mol•L﹣1醋酸和盐酸pH值分别为3、1.提示:pH=﹣lgc(H+)
结论一:醋酸在水溶液中电离 (填“完全”、“不完全”).该温度下醋酸的电离度为 ;写出醋酸的电离方程式 .
实验二:现取等体积、浓度均为1mol•L﹣1醋酸和盐酸分别加入经砂纸打磨过的表面积相同的镁条.观察放出氢气速率的快慢.
结论二:其它条件相同时,同浓度同体积的一元酸与金属反应时,反应 (填“快”或“慢”)的为弱电解质.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com