
����Ŀ������������⡣
��1����Ԫ�����ﱡĤ̫���ܵ�ز���Ϊ���Σ�����Ҫ�����黯�أ�GaAs�������ӣ�CdS����Ĥ��صȣ�
��As�Ļ�̬ԭ�ӵĵ����Ų�ʽ[Ar]_______________.
�ڵ�һ�����ܣ�As___Ga����������������������=������
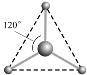
��2�������Fe(CO)5�����³�Һ̬,�۵�Ϊ-20.5 ��,������ CCl4 ��,��Fe(CO)5��______���ӣ��Ǽ��Ի��ԣ���
��3��BF3�����������壬��ǿ�ҵĽ��ܹµ��ӶԵ�����BF3��NH3�������������ɰ�ɫ���塣BF3���ӻ��������Ϊ��____ ��д���ð�ɫ����Ľṹʽ������ע�����е���λ��___________��
��4�������й�˵������ȷ����____��
A���е㣺NH3 >PH3��CH3OH > HCHO
B��SO2��CO2�Ļ�ѧ������Щ���ƣ����ռ�ṹ���ӻ���ʽ��ͬ
C���ۡ��е�: SiF4< SiCl4< SiBr4 <SiI4 , ԭ���Ƿ����й��ۼ�����������
D���۵�: CaO > KCl > KBr��ԭ���Ǿ�������С

��5���ƼغϽ����ڽ������壬ij�ֺϽ�ľ����ṹ��ͼ��ʾ��������K ԭ�ӵ���λ��Ϊ______����֪����ԭ�Ӱ뾶r��Na����r��K�������㾧��Ŀռ������� __________������ԭ���Ǹ������壩
���𰸡�3d104s24p3 > �Ǽ��� sp2 ![]() C 6
C 6 ![]()
��������
��As��33��Ԫ�أ���ԭ�ӽṹʾ��ͼΪ �����̬ԭ�ӵĵ����Ų�ʽΪ[Ar]3d104s24p3��
�����̬ԭ�ӵĵ����Ų�ʽΪ[Ar]3d104s24p3��
��ͬһ�����У�Ԫ�ص�һ�����ܳ��������ƣ���As��p���Ϊ������ṹ���Ե�һ������As��Ga�������Fe(CO)5�۵�Ϊ-20.5�棬�е�Ϊ103�棬������CCl4��CCl4�ǷǼ����ܼ������ݷ��Ӿ�����������ʣ����Ӿ����۷е�ͣ��������л��ܼ����������ڷ��Ӿ��壬�ǷǼ��Է��ӣ�
(3)Bԭ�۵�����Ϊ3���¶Ե��ӣ���BF3���ӻ��������Ϊsp2��Bԭ����ǿ�ҵĽ��ܹµ��ӶԵ�����NH3������Nԭ����һ���µ��Ӷԣ�BF3��NH3�������������ɰ�ɫ����BF3NH3���ð�ɫ����ĽṹʽΪ![]() ��
��
(4)A��NH3��CH3OH���Ӽ�������������Ӧ�ķе�ϸߣ���е�NH3 >PH3��CH3OH > HCHO����A��ȷ��B�����������������̼��Ϊ�����������ѧ�������ƣ�������̼����Ϊsp2�ӻ���ֱ���ͽṹ������������Ϊsp4�ӻ���V�νṹ����B��ȷ��C��SiF4��SiCl4��SiBr4 ��SiI4 �ṹ���ƣ���Է�������Խ���Ӽ�������Խ�����ۡ��е�Խ�ߣ��빲�ۼ����أ���C����D�����Ӿ���ľ�����Խ���ۡ��е�Խ�ߣ���D��ȷ����ΪC��
(5)���ݾ�̯����֪����������ԭ����Ϊ12��![]() =3����ԭ����Ϊ8��
=3����ԭ����Ϊ8��![]() =1�����ԺϽ�Ļ�ѧʽΪKNa3�����ݾ���ͼ��֪��ÿ��Kԭ����Χ��6����ԭ�ӣ����Ծ�����Kԭ�ӵ���λ��Ϊ6����������ԭ�Ӻͼ�ԭ�����֮��Ϊ
=1�����ԺϽ�Ļ�ѧʽΪKNa3�����ݾ���ͼ��֪��ÿ��Kԭ����Χ��6����ԭ�ӣ����Ծ�����Kԭ�ӵ���λ��Ϊ6����������ԭ�Ӻͼ�ԭ�����֮��Ϊ![]() ��(r3(Na)��3+r3(K))�����ݾ����Ľṹ��֪�������ı߳�Ϊ��ԭ�Ӻͼ�ԭ�ӵ�ֱ��֮��Ϊ2��[r(Na)+r(K)]�����Ծ��������Ϊ[2��r(Na)+2��r(K)]3������Ŀռ�������Ϊ
��(r3(Na)��3+r3(K))�����ݾ����Ľṹ��֪�������ı߳�Ϊ��ԭ�Ӻͼ�ԭ�ӵ�ֱ��֮��Ϊ2��[r(Na)+r(K)]�����Ծ��������Ϊ[2��r(Na)+2��r(K)]3������Ŀռ�������Ϊ![]() =
=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.������ĵ��뷽��ʽΪ��HClO �� H+ �� ClO��
B.c(H+)����1��10��7mol��L��1����Һһ����������Һ
C.��CH3COONa��Һ�У�c(CH3COO��) < c(Na+)
D.0.2 mol��L��1 CH3COOH��Һ�е�c(H+)��0.1 mol��L��1 HCl��Һ�е�c(H+)��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1��105 Pa��298 K�����£�2 mol����ȼ������ˮ�����ų�484 kJ�����������Ȼ�ѧ����ʽ��ȷ����(����)
A.H2O(g)= H2(g)��![]() O2(g)����H��242 kJ��mol��1
O2(g)����H��242 kJ��mol��1
B.2H2(g)��O2(g)= 2H2O(l)����H����484 kJ��mol��1
C.H2(g)��![]() O2(g)= H2O(g)����H��242 kJ��mol��1
O2(g)= H2O(g)����H��242 kJ��mol��1
D.2H2(g)��O2(g)= 2H2O(g)����H��484 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20����50�����ѧ������۲���ӶԻ���ģ��(���VSEPRģ��)������Ԥ���������ṹ����Ҫ����Ը���Ϊ��
����AXnEm��ʾֻ��һ������ԭ�ӵķ�����ɣ�AΪ����ԭ�ӣ�XΪ������ԭ�����ϵ�ԭ�ӣ�EΪ����ԭ�������δ����ɼ��ĵ��Ӷ�(��Ϊ�¶Ե���)��(n��m)��Ϊ�۲���Ӷ����������еļ۲���Ӷ����ǻ����ų������ȵķֲ�������ԭ����Χ�Ŀռ���
���ӵ����幹����ָ�����е�ԭ���ڿռ���Ų�������������ԭ��δ�ɼ��ŶԵ��ӣ�
�����м۲���Ӷ�֮��ij�����Ҫ˳��Ϊ��i���¶Ե���֮��ij������¶Ե��Ӷ�
�빲�õ��Ӷ�֮��ij��������õ��Ӷ�֮��ij�����ii��˫����˫��֮��ij�����˫���뵥��֮��ij����������뵥��֮��ij�����iii��Xԭ�ӵõ�������Խ����A��X�γɵĹ��õ��Ӷ�֮��ij���Խǿ�� ����ϸ�Ķ��������ϣ��ش��������⣺
(1)ָ���������ʷ��ӻ����ӵĿռ乹�ͣ�PO43-_____________________________�� PCl5_____________________��
(2) �����ֻ��Է�Ӧ�м����������ǵ����о�����1��̼ԭ�Ӻ�3����ԭ�ӡ�����������������������������ģ�ͣ�д����Ӧ�Ļ�ѧʽ��
 __________________��
__________________�� __________________��
__________________��
(3) ��Ҫ��д���ڶ����ڷǽ���Ԫ�ع��ɵ����Է��ӵĻ�ѧʽ��ƽ�������η���___________�������η���___________���������η���_____________��
(4) ����һ�����м����ɴ�С˳������Ϊ____________________(�ñ����д)
��HCN ��SiF4 ��SCl2 ��CO32�� ��H3O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ž��з���Ԫ��������150���ꡣ�±���Ԫ�����ڱ���һ���֣�W��X��Y��ZΪ����������Ԫ�أ�W��X������ϼ�֮��Ϊ8������˵���������
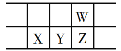
A. ԭ�Ӱ뾶��W<X
B. ���³�ѹ�£�Y����Ϊ��̬
C. ��̬�⻯�����ȶ��ԣ�Z<W
D. X������������ˮ������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����������M�Է��ѻ�ù���нϺõ��־����ԣ���ϳ�·������ͼ��ʾ��

��֪��
![]()
�ش��������⣺
��1��������C�еĺ���������Ϊ____________����Ӧ�ܵķ�Ӧ����Ϊ____________��
��2��д��E�Ľṹ��ʽ��________________________��
��3��д����Ӧ�ڵĻ�ѧ����ʽ��_____________________________________________��
��4��д��������C��������������һ��ͬ���칹��Ľṹ��ʽ��_________________��
�� �������ṹ�����ڼ��������·���ˮ�⣻
�� ����FeCl3������ɫ��Ӧ��
�� �����к���4�ֲ�ͬ��ѧ�������⡣
��5����֪CH3CH2CN![]() CH3CH2COOH������
CH3CH2COOH������ ��CH2==CHCN���Ҵ�Ϊԭ�Ϻϳɻ�����
��CH2==CHCN���Ҵ�Ϊԭ�Ϻϳɻ����� ![]() ��д���Ʊ��ĺϳ�·������ͼ(���Լ�����)_____��
��д���Ʊ��ĺϳ�·������ͼ(���Լ�����)_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��C(s)+CO2(g)![]() 2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
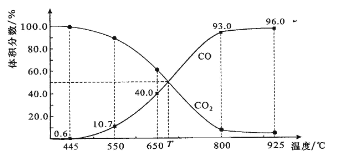
��֪�������ѹ��P����=������ѹ��P�������������������˵����ȷ����
A. 550��ʱ��������������壬������ ����С��ƽ�ⲻ�ƶ�
B. 650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ25.0%
C. T��ʱ��������������CO2��CO��ƽ�����淴Ӧ�����ƶ�
D. 925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP=24.0P��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaOH��Һ�����ڶ�������Ĵ�����
(1)CO2���������壬����NaOH��Һ���յõ�Na2CO3��NaHCO3��
��Na2CO3�׳ƴ����CO32��ˮ���ʹ��ˮ��Һ�ʼ��ԣ�д��CO32����һ��ˮ������ӷ���ʽ_________����֪25��ʱ��CO32����һ��ˮ���ƽ�ⳣ��Kh=2��10��4mol/L������Һ��c��HCO3������c��CO32����=20��1 ʱ����Һ��pH=_____��
����ĭ�������ͨ��װ��NaHCO3 ��Һ��Al2(SO4)3��Һ����д����������Һ���ʱ�����ӷ�Ӧ����ʽ__________��
(2)������Ũ���ᷴӦ������NO2����NaOH��Һ���գ���Ӧ����ʽΪ��2NO2+2NaOH=NaNO3+NaNO2+H2O����0.2molNaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ҺBΪ0��lmolL��1CH3COONa��Һ����������Һ��c��NO3������c��NO2������c��CH3COO�����ɴ�С��˳��Ϊ___________����֪HNO2�ĵ��볣��Ka=7.1��10��4molL��1��CH3COOH�ĵ��볣��Ka=1.7��10��5molL��1������ʹ��ҺA����ҺB�� pH��ȵķ�����_____��
A������ҺA�м�����NaOH B������ҺA�м�����ˮ
C������ҺB�м�����NaOH D������ҺB�м�����ˮ
(3)�����е�SO2���������꣬����������������Һ���ա�����SO2�Ĺ����У���Һ��H2SO3��HSO3����SO32��������ռ���ʵ���������a����pH�仯�Ĺ�ϵ��ͼ��ʾ��
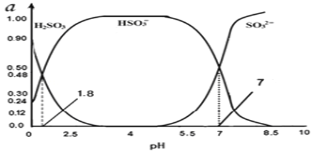
��ͼ��pH=7ʱ����Һ������Ũ�ȹ�ϵ��ȷ����___��
A��c��Na+����2c��SO32������c��HSO3����
B��c��Na+��=c��SO32����+c��HSO3����+c��H2SO3��
C��c��OH����=c��H+��+c��H2SO3��+c��HSO3����
D��c��Na+����c��HSO3������c��SO32������c��H+��=c��OH����
��������ͼ�����ݣ���ӦH2SO3![]() H++ HSO3����ƽ�ⳣ������ֵ____��
H++ HSO3����ƽ�ⳣ������ֵ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(Fe2O3)���������ᡢ��ī����ҵ����ҵ����һ������������������(��Ҫ�ɷ�ΪFe2O3��Fe3O4������������������)Ϊ��Ҫԭ���Ʊ������һ�ֹ����������£�

��֪��ijЩ����Ԫ��(��Cu��Fe��Ag��)����������NH3��H2O��OH����SCN�����γɿ���������
(1) ��ҵ������������������������ٽ��������������Ŀ����________��
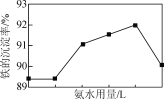
(2) �������ʱ���������˹���̫���ԭ����________��
(3) ������1��������Һ�к��е���������________��
(4) �������������У�����NH4HCO3�������䣬���ij������氱ˮ�����仯����ͼ��ʾ������ˮ��������һ�����ʱ�����ij������½�������ܵ�ԭ����________��
(5) ������2��������������Ҫ�ɷ�ΪFeOOH��FeCO3��������Һ�е���Ҫ������________(�ѧʽ)��
(6) д��FeCO3�ڿ����б�����������Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com