
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O =4NaOH+O2↑ | B.Cl2 + H2O  HClO + HCl HClO + HCl |
| C.2F2+2H2O=4HF+O2 | D.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:单选题
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是
| A.1:2混合的PbO2、Pb3O4 |
| B.1:1混合的Pb3O4、PbO |
| C.1:2:4混合的PbO2、Pb3O4、PbO |
| D.1:4:1混合的PbO2、Pb3O4、PbO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,1 mol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比为1:3,则反应过程中转移的电子为
| A.2 mol | B.3 mol | C.4mol | D.5 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
做好环境消毒工作是预防“禽流感”的重要措施,常用的一种消毒剂是ClO2,实验室可通过以下反应制得ClO2(未配平):KClO3+H2C2O4+H2SO4―→ClO2↑+K2SO4+CO2↑+H2O。下列说法正确的是( )
| A.H2SO4在反应中作氧化剂 |
| B.ClO2是氧化产物 |
| C.H2C2O4在反应中被氧化 |
| D.1 mol KClO3参加反应时有2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、
0.1 mol/L,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是( )
| A.0.15 mol/L | B.0.225 mol/L |
| C.0.30 mol/L | D.0.45 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为:SO2+2Fe3++2H2O=SO42—+2Fe2++W ①
Cr2O72—+aFe2++bH+―→Cr3++Fe3++H2O ②。
下列有关说法正确的是( )。
| A.还原性:Cr3+>SO2 |
| B.方程式②中,a=6,b=7 |
| C.Cr2O72—能将Na2SO3氧化成Na2SO4 |
| D.方程式①中W为OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法不正确的是( )
| A.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
C.N(NO2)3( )既有氧化性又有还原性 )既有氧化性又有还原性 |
| D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH="-574" kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH="-1" 160 kJ·mol-1
下列说法不正确的是( )
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)ΔH="-Q" ,Q>574 kJ·mol-1 |
| B.等物质的量的甲烷分别参加反应①、②,则反应转移的电子数不同 |
| C.若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ |
| D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )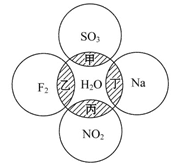
| A.甲 | B.乙 | C.丙 | D.丁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com