
分析 发生反应CaCO3+2HCl=CaCl2+H2O+CO2↑,设至少需要含碳酸钙90.0%的石灰石的质量为x,则碳酸钙质量为90%x,设生成的氯化钙的物质的量y,根据方程式中定量关系计算.
解答 解:设至少需要含碳酸钙90.0%的石灰石的质量为x,生成的氯化钙的物质的量y,盐酸的物质的量为z,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100g 2mol 1mol 22.4L
90%x z y 5.6L
$\frac{100}{90%x}=\frac{1}{y}=\frac{22.4}{5.6}$
解之得:x=$\frac{100g×5.6L}{22.4L×90%}$=27.8g
y=$\frac{1mol×5.6L}{22.4L}$=0.25mol
需要的CO2的质量是$\frac{5.6}{22.4}×44$克=11克,
答:(1)需要的CO2的质量是11克;
(2)至少需要含碳酸钙90.0%的石灰石27.8g;
(3)生成的氯化钙的物质的量是0.25mol.
点评 本题考查化学方程式的有关计算,关键是理解方程式中各个物理量之间的关系,注意左右单位不一致时,应左右单位相当,上下单位一致.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| C | D | E | |||||
| F | G | H | I | J | K |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
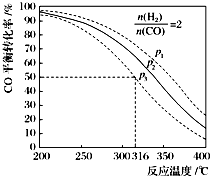 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
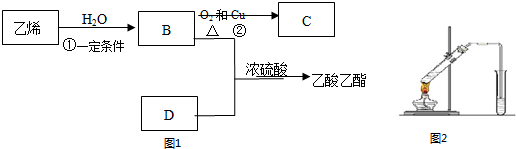
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
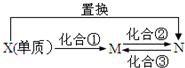 M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )
M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )| A. | X可以是Mg或Cu元素 | |
| B. | 化合②③的反应可以是非氧化还原反应 | |
| C. | 若X为C元素,则该转化关系中X单质发生的置换反应可以是2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| D. | 若X为Fe元素,则M的H218O溶液中加入固体Na2O2的反应为:4Fe3++6H218O+6Na2O2═4Fe(OH)3↓+12Na++318O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极得电子,质量减轻 | |
| B. | 放电时电解质溶液中的OH-向正极移动 | |
| C. | 充电时阴极附近溶液的pH减小 | |
| D. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| B. | 同周期主族元素离子半径从左到右依次减小 | |
| C. | HF、HCl、HBr、HI 的热稳定性依次减弱,还原性和水溶液的酸性依次增强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com