
| A. | 控制工业废水的排放 | B. | 对河水进行消毒处理 | ||
| C. | 控制农田排水 | D. | 减少用水量 |
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| M | N | ||
| X | Y |
| A. | 元素的第一电离能X<Y | |
| B. | X位于第三周期 IIA,其单质可采用电解熔融其氯代物制备 | |
| C. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| D. | 气体分子(MN)2的电子式为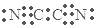 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的蓝色石蕊试纸检验某种气体是否是NH3 | |
| B. | 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中一定含有Fe3+ | |
| C. | 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH | |
| D. | 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取53.0g Na2CO3固体 | |
| B. | 需要的玻璃仪器有500mL容量瓶、烧杯、玻璃棒、胶头滴管、量筒 | |
| C. | 转移溶液时有少量液体溅出,则最终溶液的浓度偏高 | |
| D. | 定容时仰视刻度线,则最终溶液的浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
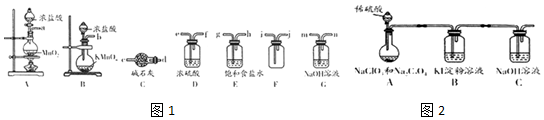
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡所需的时间为:甲>乙 | B. | 甲的转化率>乙的转化率 | ||
| C. | 混合气体中SO3的含量为:甲>乙 | D. | 气体的总物质的量:甲<乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com