
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( ) 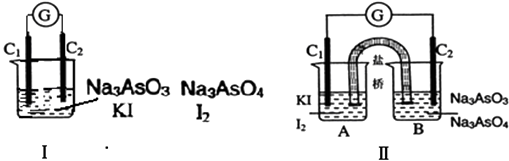
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2+2e﹣═2I﹣
【答案】BD
【解析】解:A.甲组操作时,两个电极均为碳棒,不发生原电池反应,则微安表(G)指针不发生偏转,故A错误;
B.发生反应生成碘单质,则溶液颜色加深,故B正确;
C.乙组操作时,C2做负极,因As元素失去电子,故C错误;
D.乙组操作时,C1上得到电子,为正极,发生的电极反应为I2+2e﹣═2I﹣,故D正确;
故选BD.
甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸,发生氧化还原反应,不发生原电池反应,以此分析A、B;
乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液,不发生化学反应,发生原电池反应,A中发生I2+2e﹣═2I﹣,为正极反应,而B中As化合价升高,发生氧化反应,以此分析C、D.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2的燃烧热是akJ/mol,由H2、CO按3:1比例组成的混合物2mol,完全燃烧并恢复到常温吋,放出的热量为bkJ,则CO的燃烧热为(kJ/mol)为( )
A.2b﹣3a
B.3a﹣2b
C.![]() (2b﹣3a)
(2b﹣3a)
D.![]() (a﹣2b)
(a﹣2b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素全部是微量元素的是 ( )
A. Na 、K、Cl、S、O B. Fe、Zn、Cu、B
C. N、H、P、C D. Ge、CA、Cu、Mg、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( ) 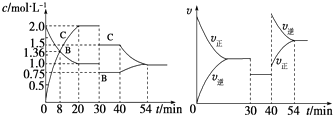
A.8 min时表示正反应速率等于逆反应速率
B.前20 min A的反应速率为0.05 molL﹣1min﹣1
C.反应方程式中的x=1,30 min时表示增大压强
D.40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com