
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物.
解答 解:①O2中O原子之间只存在共价键,为单质;
②NaCl中钠离子和氯离子之间只存在离子键,为离子化合物;
③H2SO4中只存在共价键,为共价化合物;
④H2O只存在共价键,属于共价化合物;
⑤NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,为离子化合物;
⑥NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,为离子化合物;
⑦Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在共价键,为离子化合物;
通过以上分析知,只存在共价键的是①③④,只存在离子键的是②,属于共价化合物的是③④,
故答案为:①③④;②;③④.
点评 本题考查了化学键和化合物的判断,题目难度不大,根据物质的构成微粒及微粒间的作用力来分析解答,注意硫酸氢钠在水溶液里或熔融状态下电离方程式的区别,知道稀有气体中不存在化学键,为易错点.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:填空题
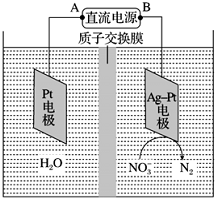 电化学降解NO3-的原理如图所示.
电化学降解NO3-的原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
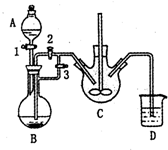 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,氢元素含量最高的烃的分子式CH4.
,氢元素含量最高的烃的分子式CH4.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
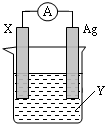 依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇、甲醛分子间都可以形成氢键 | |
| B. | 甲醇分子内C原子C原子采取sp2杂化,O原子采取sp杂化 | |
| C. | 甲醛为极性分子,分子中两个C-H键夹角小于120° | |
| D. | 甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com