
 .
.分析 (1)①Y是黄绿色气体,则Y为氯气,若A、B的物质的量之比为1:4,则该反应为二氧化锰与浓盐酸的反应,据此答题;
②若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:6,则该反应为浓盐酸与氯酸钾反应来制取氯气;
(2)A为金属单质,B为无色油状黏稠液体,则该反应考虑为浓硫酸与金属的反应,当 A、B的物质的量之比为1:2时,则A应为+2价金属,或为非金属单质CC,刺激性气体产物X应为二氧化硫;
(3)常温下A在B的浓溶液中会“钝化”,若A为金属单质,A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,X为3Fe(NO3)3,Y为NO;
(4)向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有Na元素,A与B按物质的量之比1:4恰好反应,该反应是氯化铝与氢氧化钠反应,溶液中溶质为生成物:偏铝酸钠、氯化钠.
解答 解:(1)①Y是黄绿色气体,则Y为氯气,若A、B的物质的量之比为1:4,则该反应为二氧化锰与浓盐酸的反应,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:6,则该反应为浓盐酸与氯酸钾反应来制取氯气,该反应的化学方程式,并用双线桥表示反应过程中的电子转移为 ,
,
故答案为: ;
;
(2)A为单质,B为无色油状黏稠液体,则该反应考虑为浓硫酸与金属或非金属单质的反应,当 A、B的物质的量之比为1:2时,则A应为+2价金属,则A能为铜、锌等,A为非金属单质为单质C,刺激性气味气体产物X应为二氧化硫,检验二氧化硫的方法为将气体通入品红溶液,能使溶液褪色,
故答案为:C或Cu Zn;将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2;
(3)常温下A在B的浓溶液中会“钝化”,A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,X为3Fe(NO3)3,Y为NO,
过量的铁和100mL2mol/L的硝酸溶液即含硝酸0.2mol,充分反应后得到硝酸亚铁溶液,根据反应3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O可知,硝酸亚铁的物质的量为$\frac{3}{8}$×0.2mol=0.075mol,将溶液稀释至500mL后溶液中硝酯根离子的物质的量浓度为$\frac{0.075×2}{0.5}$mol/L=0.3mol/L,
故答案为:0.3mol/L;
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有Na元素,A与B按物质的量之比1:4恰好反应,该反应是氯化铝与氢氧化钠反应,溶液中溶质为:偏铝酸钠、氯化钠,
故答案为:NaAlO2、NaCl.
点评 本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物性质,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NO${\;}_{3}^{-}$、K+、SO${\;}_{4}^{2-}$ | B. | Cu2+、Ba2+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | ||
| C. | OH-、Cl-、NH${\;}_{4}^{+}$、Na+ | D. | Mg2+、Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实 例 | 影 响 条 件 |
| 1.食物放在冰箱里能延长保质期 | A |
| 2.实验室将块状药品研细,再进行反应 | C |
| 3.用H2O2分解制O2时,加入MnO2 | B |
| 4.用9%的食用醋除水垢比3%的醋更快 | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 选用试剂 | 操作方法 |
| A | CO2(CO) | 过量O2 | 点燃 |
| B | CaO(CaCO3) | 足量蒸馏水 | 过滤、蒸发 |
| C | NaCl溶液(MgSO4溶液) | 适量BaCl2溶液 | 过滤 |
| D | FeCl2溶液(CuCl2溶液) | 足量铁粉 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
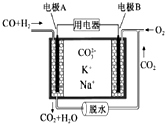
| A. | 电极A上发生的是还原反应 | |
| B. | 电池工作时,$CO_3^{2-}$向电极B移动 | |
| C. | 电极B上发生的电极反应为:O2+2CO2+4e-═2$CO_3^{2-}$ | |
| D. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com