
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| C. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| D. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
分析 A、依据平衡常数随温度变化分析判断平衡移动方向,结合平衡移动原理判断;
B、依据浓度商和平衡常数比较判断反应进行的方向;
C、恒温恒压下,向容器中再充入少量的Ar,平衡向气体体积增大的方向进行;
D、增大Ni(CO)4(g),相当于增大压强,平衡正向进行.
解答 解:A、平衡常数数据分析,平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,故A正确;
B、80℃时,测得某时刻Ni(CO)4(g)、CO(g)浓度均为0.5 mol•L-1,Qc=$\frac{c(Ni(CO)_{4})}{{c}^{4}(CO)}$=$\frac{0.5}{0.{5}^{4}}$=8>2,说明平衡逆向进行,则此时v(正)<v(逆),故B正确;
C、恒温恒压下,向容器中再充入少量的Ar,压强增大保持恒压,平衡向气体体积增大的方向进行,上述平衡将逆向移动,故C错误;
D、恒温恒容下,向容器中再充入少量的Ni(CO)4(g),相当于增大压强平衡正向进行,达到新平衡时,CO的百分含量将减小,故D错误;
故选AB.
点评 本题考查了平衡常数的计算和数据判断应用,影响平衡因素分析,掌握基础是解题关键,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
已知:
①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=﹣23.9kJ/mol
②2CH3OH(g)=C2H4(g)+2H2O(g)△H2=﹣29.1kJ/mol
③C2H5OH(g)=CH3OCH3(g)△H3=+50.7kJ/mol
则C2H4(g)+H 2O(g)=C2H5OH(g)的△H为( )
2O(g)=C2H5OH(g)的△H为( )
A.﹣45.5kJ/mol B.+45.5kJ/mol C.﹣55.9kJ/mol D.+55.9kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
2SO2+O2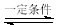 2SO3 是工业上制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3 是工业上制造硫酸的重要反应。下列关于该反应的说法正确的是
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率 
D.一定条件下达到反应限度时SO2全部转化为SO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.加大石油、煤炭的开采速度,增加化石燃料的供应量
B.推广使用燃煤脱硫技术,防治SO2污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.实施绿化工程,防治扬尘污染
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 曲线a和b表示两个反应过程的反应热不同 | |
| B. | 曲线a一定表示反应是在无催化剂时的反应过程 | |
| C. | 增大压强,X的转化率一定增大 | |
| D. | 反应达平衡,升高温度,平衡常数K值一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1的三种溶液的pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 | |
| C. | 25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大 | |
| D. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 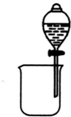 分离碘酒中的碘和酒精 | B. | 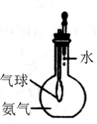 验证氨气易溶于水 | ||
| C. | 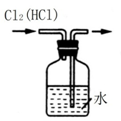 除去Cl2中的HCl杂质 | D. | 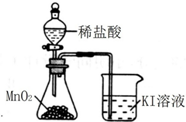 比较MnO2、Cl2、I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com