
科目:高中化学 来源:不详 题型:填空题
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 装入带活塞的密闭容器中,当反应
装入带活塞的密闭容器中,当反应 达到平衡后,慢慢压缩,下列叙述正确的是
达到平衡后,慢慢压缩,下列叙述正确的是| A.体积减半,则压强为原来的两倍 |
| B.平衡向右移动,混合气体的颜色一定会变浅 |
| C.体积减半,压强增大,但小于原来的2倍 |
| D.平衡向右移动,混合气体密度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

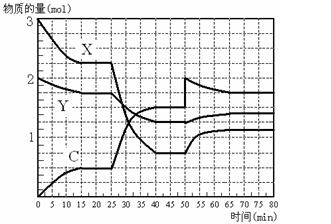
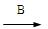 G的离子方程式 。
G的离子方程式 。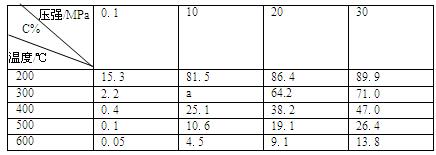

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
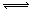 3C(g),已知加入1molA和3molB且达到平衡后,生成amolC。达到平衡后C在反应混和物中的百分含量是
3C(g),已知加入1molA和3molB且达到平衡后,生成amolC。达到平衡后C在反应混和物中的百分含量是查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 nZ(g)+2W(g)
nZ(g)+2W(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
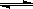 2SO3(g)
2SO3(g) 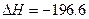 kJ·mol
kJ·mol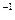 )
)| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO3 |
SO3的浓度(mol· L L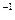 ) ) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 |  | 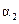 | 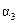 |
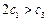 B.
B.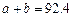 C.
C.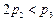 D.
D.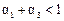
 2SO3(g)下列说法正确的是
2SO3(g)下列说法正确的是 SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。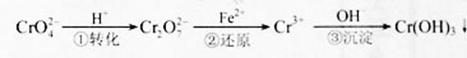

 O
O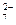
 和CrO
和CrO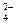 的浓度相同
的浓度相同 O
O ) ="v" (CrO
) ="v" (CrO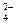 )
) O
O 离子,需要 mol的FeSO
离子,需要 mol的FeSO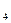 ·7H
·7H O。
O。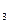 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:
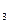 的溶度积
的溶度积 ,要使c(Cr3+)降至10
,要使c(Cr3+)降至10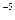 mol/L,溶液的pH应调至 。
mol/L,溶液的pH应调至 。 O
O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)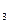 沉淀。
沉淀。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com