
【题目】写出下列化学反应方程式:
(1)乙醇催化氧化:_____;
(2)苯与浓硝酸、浓硫酸共热:_____;
(3)硬脂酸甘油脂的皂化反应:_____。
【答案】2CH3CH2OH+O2![]() 2CH3CHO+2H2O C6H6+HNO3
2CH3CHO+2H2O C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O 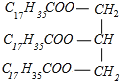 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+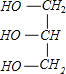 ;
;
【解析】
(1)乙醇催化氧化是乙醇在铜或银做催化剂的条件下被氧气氧化为乙醛,同时生成水,故化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(2)苯在浓硫酸的催化作用下加热能和浓硝酸发生硝化反应生成硝基苯和水,化学方程式为C6H6+HNO3![]() C6H5NO2+H2O,故答案为:C6H6+HNO3
C6H5NO2+H2O,故答案为:C6H6+HNO3![]() C6H5NO2+H2O;
C6H5NO2+H2O;
(3)硬脂酸甘油酯与氢氧化钠反应生成C17H35COONa与甘油,反应方程式为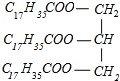 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+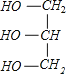 。
。


科目:高中化学 来源: 题型:
【题目】综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是____。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃时,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行放出CO2,Li4SiO4再生,说明该原理的化学方程式是____________________________________________。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O ![]() CO+H2+O2
CO+H2+O2
已知:

则反应A的热化学方程式是___________________________________________________。
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

① 电极b发生 (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,由对甲基苯酚(![]() )合成BHT的常用方法有2种(如图),下列说法不正确的是
)合成BHT的常用方法有2种(如图),下列说法不正确的是

A. BHT能使酸性KMnO4溶液褪色
B. BHT与对甲基苯酚互为同系物
C. BHT中加入浓溴水易发生取代反应
D. 方法一的原子利用率高于方法二
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图的能量图,下列说法正确的是( )

A. A2(g)+B2(g)=2AB(g)是一个放热反应
B. 2molAB(g)的总能量大于1mol A2(g)和1mol B2(g)的能量之和
C. 1mol A2(g)和1 mol B2(g)的能量之和为a kJmol﹣1
D. 2AB(g)═A2(g)+B2(g)△H=( a﹣b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.100 0 mol·L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为________。
(2)滴定至终点的颜色变化为____________。
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为__________。

(4)乙学生做了三组平行实验,数据记录如下:
实验 序号 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______。(保留四位有效数字)
(5)下列哪些操作会使测定结果偏高________(填字母)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含SO2废气的治理可以变废为宝,使硫资源得以利用。
(1)按每年全国发电燃煤8亿吨,煤中含硫质量分数以2%计,若不经过脱硫处理,则会有_______亿吨SO2排放到大气中(假设S全部转化为SO2)。
(2)下列物质中,能吸收SO2的有_____(填序号)。
a.氨水 b.酸性KMnO4溶液 c.生石灰 d.Na2CO3溶液
(3)某工厂采用(NH4)2SO3和NH4HSO3的混合溶液A吸收烟气中的SO2并制备(NH4)2SO3 ·H2O过程如下:

已知:
①“吸收”过程中,溶液中(NH4)2SO3和NH4HSO3的物质的量之比变____(填 “大”或“小”)。
②(NH4)2SO3溶液呈碱性的原因是_____。
③用不同的溶液A吸收SO2时,SO2吸收率和放空废气含NH3量的变化如下图。解释图中放空废气含NH3量增大的原因:随(NH4)2SO3的物质的量之比增大,_______。

注:不同溶液A的体积相同,所含(NH4)2SO3和NH4HSO3的总物质的量相同。
④“制备”过程中,溶液B中发生的反应方程式是______。
(4)检验产品(NH4)2SO3 ·H2O中含有少量SO42-的方法如下:取少量产品加水溶解,_____(将实验操作和现象补充完整〕。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质在水中的电离方程式书写正确的是( )
A. KHSO4=K++H++SO42- B. NaHCO3=Na++H++CO32-
C. Mg(NO3)2=Mg2++(NO3)22- D. KClO3=K++Cl5﹣+3O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 从能量的角度看,断开化学键需要___________,形成化学键需要__________。当反应物的总能量大于生成物的总能量时,该反应为_______反应;当反应物的总能量小于生成物的总能量时,该反应为 _______反应。
从能量的角度看,断开化学键需要___________,形成化学键需要__________。当反应物的总能量大于生成物的总能量时,该反应为_______反应;当反应物的总能量小于生成物的总能量时,该反应为 _______反应。
![]() 下列反应中,属于放热反应的是_______,属于吸热反应的是_______。
下列反应中,属于放热反应的是_______,属于吸热反应的是_______。
a、煅烧石灰石![]() 主要成分是
主要成分是![]() 制生石灰
制生石灰![]() ;b、燃烧木炭取暖;c、碳
;b、燃烧木炭取暖;c、碳![]() 与水蒸气的反应;d、酸与碱的中和反应;e、炸药爆炸;
与水蒸气的反应;d、酸与碱的中和反应;e、炸药爆炸;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.Z的氧化物能与Y的最高价氧化物对应的水化物反应
C.WX3和水反应生成的化合物是离子化合物
D.气态氢化物的稳定性:R<W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com