
分析 (1)水银是单质汞;
(2)钢铁在潮湿的空气中能形成原电池,Fe作负极,正极上氧气得电子;
(3)根据反应速率v=$\frac{△c}{△t}$计算,5s内从2.0mol/L变1.0mol/L,则△c=1.0mol/L,以此来解答;
(4)结合n=$\frac{m}{M}$、V=nVm计算.
解答 解:(1)硬铝、钢铁、黄铜均是合金,水银是单质汞只含有一种金属,不是合金;
故答案为:B;
(2)钢铁在潮湿的空气中能形成原电池,Fe作负极,Fe失电子生成亚铁离子,其电极方程式为:Fe-2e-=Fe2+,正极上氧气得电子,发生的是吸氧腐蚀;
故答案为:吸氧;Fe-2e-=Fe2+;
(3)5s内从2.0mol/L变1.0mol/L,则△c=1.0mol/L,v(A)=$\frac{△c}{△t}$=$\frac{1.0mol/L}{5s}$=0.2mol•L-1•s-1,v(B)=2v(A)=0.4mol•L-1•s-1;
故答案为:0.4mol•L-1•s-1;
(4)在标况下,66g 二氧化碳的物质的量为$\frac{66g}{44g/mol}$=1.5mol,所含的原子的物质的量为1.5mol×3=4.5mol,其体积为1.5mol×22.4L/mol=33.6L;
故答案为:4.5;33.6.
点评 本题考查了金属的电化学腐蚀、物质的量的有关计算,明确原电池原理、以及各个物理量之间的关系是解本题关键,根据公式来分析解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
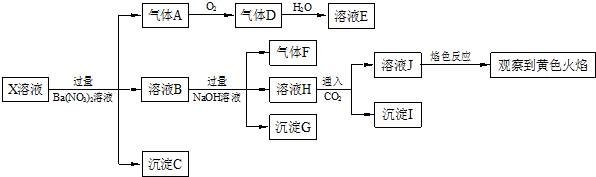
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是 A13+、Na+、K+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与醋酸溶液反应:CaCO3+2H +═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水和盐酸反应:OH-+H+═H2O | |
| C. | 用Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 偏铝酸钠溶液通入过量CO2:AlO2-+4CO2+2 H2O═Al3++4 HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 可将地下输油钢管与外加直流电的正极相连以保护它不受腐蚀 | |
| C. | 自然界中钢铁的腐蚀以析氢腐蚀为主 | |
| D. | 生铁在海水中的腐蚀速度比在空气中快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0800 | B. | 0.1200 | C. | 0.1600 | D. | 0.2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com