
| A. | 等浓度的氨水与氯化铵溶液中,前者c(NH${\;}_{4}^{+}$)大 | |
| B. | CH3COONa溶液中滴加少量浓盐酸后,水电离程度增大 | |
| C. | 向Na2CO3溶液中加入NaOH溶液后,c(CO${\;}_{3}^{2-}$)增大 | |
| D. | 室温时AgCl分别加入水中与AgNO3溶液中,前者溶度积常数大 |
分析 A.氨水为弱碱,在溶液中的电离程度较小,氯化铵溶液中铵根离子的水解程度较小;
B.醋酸根离子水解促进了水的电离,醋酸根离子浓度越大,水的电离程度越大;
C.氢氧化钠电离出的氢氧根离子抑制了碳酸根离子的水解;
D.温度不变,难溶物溶度积不变.
解答 解:A.等浓度的氨水与氯化铵溶液中,由于氨水电离程度较小,氯化铵溶液中铵根离子的水解程度较小,则前者溶液中的c(NH4+)较小,故A错误;
B.CH3COONa溶液中滴加少量浓盐酸后,溶液中醋酸根离子浓度减小,水电离程度会减小,故B错误;
C.碳酸根离子水解溶液呈碱性,向Na2CO3溶液中加入NaOH溶液后,氢氧根离子浓度增大,碳酸根离子的水解程度减小,则c(CO32-)增大,故C正确;
D.室温时AgCl分别加入水中与AgNO3溶液中,由于温度不变,则两溶液的溶度积不变,故D错误;
故选C.
点评 本题考查了盐的水解原理、难溶物溶解平衡及其影响、离子浓度大小比较等知识,题目难度不大,明确盐的水解原理及其影响为解答关键,注意溶度积与温度有关,与溶液浓度大小无关,为易错点.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 辛烯和3-甲基-1-丁烯 | B. | 甲苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 甲基环己烷和己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
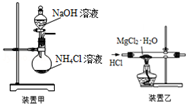
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 使用分液漏斗和容量瓶时,首先要查是否漏水 | |
| C. | 实验室用装置甲制取NH3 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类利用能源的三个阶段分别是:柴草时期、化石能源时期、多能源结构时期 | |
| B. | 人类使用沼气是对化学能的充分利用 | |
| C. | 发展低碳经济、循环经济,开发推广太阳能、水能、风能等能源,减少煤、石油等化石燃料的使用 | |
| D. | 生物质能主要指用树木、庄稼、草类等植物直接或间接提供的能量,它是不可再生的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为 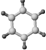 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点由高到低的排列顺序:HF>HI>HBr>HCl | |
| B. | PCl3和BF3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2O是极性分子,分子中O原子不处在2个H原子所连直线的中央 | |
| D. | 离子晶体可含有极性共价键,也可含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe位于元素周期表的第四周期ⅧB族 | |
| B. | ${\;}_{22}^{46}$TiO2、${\;}_{22}^{48}$TiO2、${\;}_{22}^{50}$TiO2互为同位素 | |
| C. | 工业上利用热还原法冶炼金属Fe | |
| D. | ${\;}_{41}^{92}Nb$3+原子核内有51个中子,核外有41个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 检验次数 | 溶液中检验出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NH4Cl |
| 第二次 | NH4Cl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、NH4Cl、K2CO3、NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com