
分析 (1)2g乙醇的物质的量=$\frac{2g}{46g/mol}$=$\frac{1}{23}$mol,2g乙醇完全燃烧生成CO2和液态水,同时放出59.4 kJ热量,1mol乙醇完全燃烧生成二氧化碳和液态水放出的热量为=-1366.2kJ,据此书写热化学方程式;
(2)pH相等的氢氧化钡和氨水,氨水浓度大于氢氧化钡2倍,滴加等浓度稀盐酸中和,需要盐酸体积与碱的物质的量成正比;
(3)①相同条件下既能向正反应方向进行同时又能向逆反应方向进行的反应为可逆反应;
原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置;
②酸性条件下,Ni(OH)2和Cd(OH)2都能溶解生成重金属盐.
解答 解:(1)2g乙醇的物质的量=$\frac{2g}{46g/mol}$=$\frac{1}{23}$mol,2g乙醇完全燃烧生成CO2和液态水,同时放出59.4 kJ热量,1mol乙醇完全燃烧生成二氧化碳和液态水放出的热量为=-1366.2kJ,所以其热化学方程式为C2H5OH(l)+2O2(g)=2CO2(g)+3H2O(l)△H=-1366.2 kJ/mol,
故答案为:C2H5OH(l)+2O2(g)=2CO2(g)+3H2O(l)△H=-1366.2 kJ/mol;
(2)pH相等的氢氧化钡和氨水,氨水浓度大于氢氧化钡2倍,pH相同、体积相同的氢氧化钡和氨水,氨水物质的量大于氢氧化钡二倍,滴加等浓度稀盐酸中和,需要盐酸体积与碱的物质的量成正比,所以V1<V2,
故答案为:<;
(3)①相同条件下既能向正反应方向进行同时又能向逆反应方向进行的反应为可逆反应;
原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置;
该反应正逆反应条件不同,所以不是可逆反应;
放电时是将化学能转化为电能,充电时是将电能转化为化学能,
故选B;
②酸性条件下,Ni(OH)2和Cd(OH)2都能溶解生成重金属盐,重金属盐能使人产生中毒,从而影响人体健康,所以酸性土壤中这种污染尤为严重,故答案为:Ni(OH)2和Cd(OH)2能溶于酸性溶液.
点评 本题考查原电池和电解池原理、热化学方程式书写、弱电解质电离等知识点,侧重考查分析、计算能力,注意反应热与化学计量数有关,题目难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH增大 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④电池负极的电极反应式为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
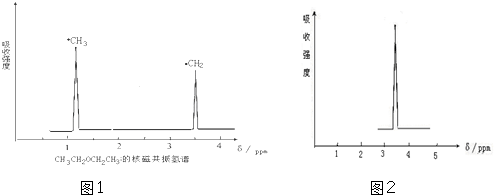
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
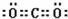 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 煤燃烧时化学能主要转化为热能 | |
| C. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| D. | 白炽灯工作时电能全部转变成光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某原子K层上只有一个电子 | |
| B. | 某离子L层和M层上的电子数均为K层的4倍 | |
| C. | 某离子M层上的电子数为L层上的4倍 | |
| D. | 某离子的核电荷数与最外层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成相同的化合物 | B. | 分子构造相同的化合物 | ||
| C. | 分子组成相同而构造不同的化合物 | D. | 分子组成与构造都不相同的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应均应透过蓝色钴玻璃观察 | |
| B. | NaC1与Na2CO3灼烧时火焰颜色相同 | |
| C. | 焰色反应是化学变化 | |
| D. | 所有金属及其化合物灼烧时火焰均有颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com