
【题目】金属钠是实验室里常用的一种化学试剂,请回答下列问题:
(1)在实验室里,取用沉浸在煤油中的金属钠的操作方法是__________________。
(2)在空气中切开一块金属钠,可看到断面呈________色,具有金属光泽,但断面很快变____________,主要是由于生成一薄层____________。
(3)若把钠放在石棉网上加热可观察到____________________________________,反应的化学方程式是______________________________。
【答案】用镊子夹取一小块钠,用滤纸吸干表面的煤油,放在玻璃片上,用小刀切下黄豆粒大小的一小块钠,剩余的立刻放回原瓶 银白 暗 氧化钠 先熔化成光亮的银白色小球,后剧烈燃烧,发出黄色火焰,生成淡黄色固体 2Na+O2![]() Na2O2
Na2O2
【解析】
钠的性质很活泼,能够与氧气、水等发生反应,钠为银白色,质软、熔点低,密度比水小,据以上分析解答。
(1)钠质地软,易氧化,密度比煤油大,在实验室里,取用沉浸在煤油中的金属钠的操作方法是:用镊子夹取一小块钠,用滤纸吸干表面的煤油,放在玻璃片上,用小刀切下黄豆粒大小的一小块钠,剩余的立刻放回原瓶;
故答案为:用镊子夹取一小块钠,用滤纸吸干表面的煤油,放在玻璃片上,用小刀切下黄豆粒大小的一小块钠,剩余的立刻放回原瓶;
(2)钠是银白色易氧化的金属,在空气中切开一块金属钠,可看到断面呈银白色,具有金属光泽,但断面很快变暗,主要是由于生成一薄层氧化钠;
故答案为:银白; 暗 ; 氧化钠;
(3)钠在氧气中燃烧,生成过氧化钠,若把钠放在石棉网上加热可观察到先熔化成光亮的银白色小球,后剧烈燃烧,发出黄色火焰,生成淡黄色固体,反应的化学方程式是2Na+O2![]() Na2O2;
Na2O2;
故答案为:先熔化成光亮的银白色小球,后剧烈燃烧,发出黄色火焰,生成淡黄色固体 ;2Na+O2![]() Na2O2。
Na2O2。


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水、易吸潮等性质。实验室用工业大理石(含少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下(已知步骤Ⅲ的滤液中不含![]() )。
)。
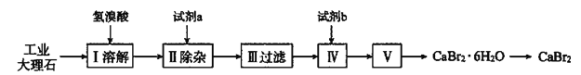
下列说法错误的是( )
A.试剂a可以是生石灰,试剂b是氢溴酸
B.步骤V所含的操作依次是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C.为将杂质离子除尽,步骤Ⅱ需加过量试剂a,保证溶液呈强碱性
D.工业上常用氨气与溴、石灰乳反应制取溴化钙,若反应中氧化剂与还原剂的物质的量比为3∶2,则产物中会生成一种无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量浓度最大的是
A. 150 mL1 mol/L NaCl溶液 B. 50 mL2mol/L NH4Cl溶液
C. 150 mL 0.5 mol/L CaCl2溶液 D. 50 mL l mol/L AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题.
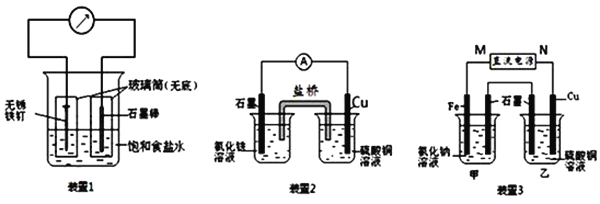
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______.
(2)装置2中的石墨是______极(填“正”或“负”),该装置发生的总反应的离子方程式为______.
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为______极;甲烧杯中铁电极的电极反应为______.
②乙烧杯中电解反应的离子方程式为______.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为______mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M 在周期表中的位置关系如右图,对这些元素形成的单质或化合物推测正确的是( )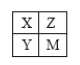
A.若Z元素形成的单质是Z2,则M元素形成的单质也一定是M2
B.若HnX常温下是气体,则HmZ 常温下也是气体
C.若有碱M(OH)n,则也一定有碱Y(OH)m
D.若Y有最高价含氧酸HnYOm,则X也一定有最高价含氧酸HnXOm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A. 升高温度,K减小 B. 减小压强,n(CO2)增加
C. 更换高效催化剂,α(CO)增大 D. 充入一定量的氮气,n(H2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有未知浓度的盐酸25 mL,能跟20 mL某浓度的氢氧化钠溶液完全反应。若先用0.1 g 碳酸钙与25 mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4 mL才能中和。求盐酸和氢氧化钠溶液中溶质的物质的量浓度分别是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制1 molL﹣1的NaOH溶液450 mL。请回答下列问题:
(1)计算:需要称取NaOH固体__g。
(2)配制时,必须使用的仪器有托盘天平(带砝码)、药匙、烧杯、玻璃棒、量简,还缺少的仪器是__、__。(填仪器名称)
(3)在使用容量瓶前必须进行的一步操作是__。
(4)实验两次用到玻璃棒,其作用分别是:先用于__、后用于__。
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是__(填字母)。
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.天平砝码生锈
C.配制过程中遗漏了洗涤步骤
D.未冷却到室温就注入容量瓶
E.加蒸馏水时不慎超过了刻度线
F.定容观察液面时俯视
(6)若实验过程中出现(5)中D这种情况你将如何处理?__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是

A. 该原电池的正极反应是:Zn-2e-=Zn2+
B. 左烧杯中溶液的红色逐渐褪去
C. 该电池铂电极上立即有气泡出现
D. 该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com