
| A、Na+ K+ HCO3- Cl- |
| B、NH4+ Mg2+ SO42- Cl- |
| C、K+ Na+ SO42- CH3COO- |
| D、K+ Ca2+ CO32- NO3- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Br->Fe2+>I- |
| B、I->Fe2+>Br- |
| C、Br->I->Fe2+ |
| D、Fe2+>I->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温. |
| Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解. |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红. |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
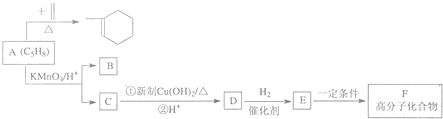
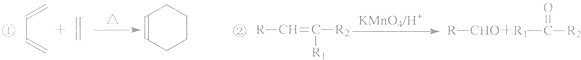
 时,A发生的反应类型为
时,A发生的反应类型为查看答案和解析>>
科目:高中化学 来源: 题型:
A、氟离子的结构示意图: |
B、CH4的比例模型: |
C、羧基的电子式: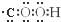 |
| D、NaHCO3的电离方程式:NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
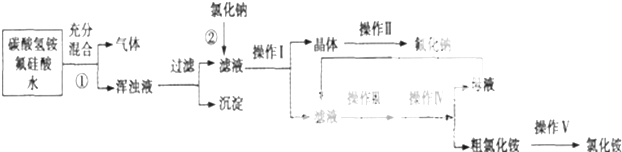
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g、cm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
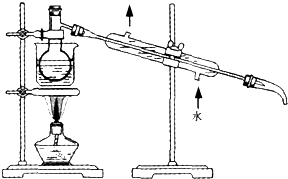
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、接触法制硫酸:氧化炉、硫铁矿、V2O5、400℃-500℃ |
| B、联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收二氧化碳 |
| C、合成氨:沸腾炉、焦炭、铁触媒、500℃ |
| D、氨氧化法制硝酸:合成塔、空气、铂铑合金、800℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
| ||
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com