
| ||
| ||
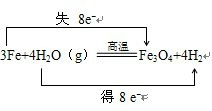 ,
,
| ||
 、Fe、2;
、Fe、2;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用前要检查容量瓶是否漏液 |
| B、用蒸馏水洗后必须要将容量瓶烘干 |
| C、为了操作简便,浓溶液稀释可直接在容量瓶中进行 |
| D、为了使所配溶液浓度均匀,定容结束后,手握瓶颈左右振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | V(NaOH) | V(HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.02 | 0.00 | 16.69 | 16.69 | 0.1042 |
| 2 | 16.71 | 0.00 | 17.90 | 17.90 | |
| 3 | 19.52 | 0.00 | 20.79 | 20.79 | 0.1065 |
| 4 | 14.99 | 0.00 | 16.02 | 16.02 | 0.1069 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com